
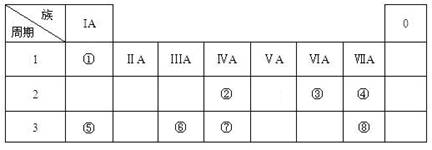
(13分) 下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素④和⑥的第一电离能大小顺序是 > (用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式 ,其VSEPR构型为 。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为 。

⑧的常见离子和④的最简单氢化物形成的配离子的名称为 ,
其水溶液颜色为 。
(1)1s22s22p63s23p63d54s1
(1分) ds (1分) (1分)
(1分)
(2)sp2 和 sp3 (1分)
(3)F > N (2分);NO2+ (1分),直线形(1分)
(4)HF分子间存在氢键,易形成缔合分子(HF)n (2分)
(5)Cu3 N (1分); 四氨合铜离子(1 分), 或其它合理答案);深蓝色(1分)
【解析】根据元素在周期表中的位置可知,①~⑧分别是H、Be、C、N、O、F、Cr、Cu。
(1)根据构造原理可知,Cr的基态原子排布式为1s22s22p63s23p63d54s1。区的名称来自于按照构造原理最后填入电子能极的轨道名称,所以根据构造原理可知,Cu位于ds。同样根据构造原理可知,氧原子的价层电子的轨道表示式为 。
。
(2)化合物对氢气的相对密度为23,则相对分子质量是46。又因为H、C、O三种元素的质量比为1:6:16,所以化学式为CH2O2,即是甲酸,结构简式为HCOOH。其中碳原子是sp2杂化,两个氧原子,一个是sp2杂化,另一个是sp3杂化。
(3)非金属性越强,第一电离能越大,所以F的第一电离能大于N的。价电子数和原子数分别都相等的是等电子体,所以有N和O形成的与N3-互为等电子体的离子的化学式为NO2+ 。其中氮原子含有的孤对电子对数是(5-1-2×2)÷2=0,所以是直线型结构。
(4)由于HF分子间存在氢键,易形成缔合分子(HF)n,所以测得值偏高。
(5)根据晶胞结构可知,含有氮原子是8×1/8=1,铜原子是12×1/4=3,所以化学式为Cu3 N。铜离子和氨气通过配位键形成四氨合铜离子,溶液显深蓝色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年重庆市重庆一中高二上学期期中考试文科化学试卷(带解析) 题型:填空题
(7分)下表为元素周期表的前三周期。
回答下列问题:
(1)写出元素符号⑤ ⑦ 。
(2)表中所列元素中,金属性最强的元素是 (填元素符号,下同),非金属性最强的元素是 ;最高价氧化物对应水化物中,酸性最强的是 (填化学式)。
(3)①、②、③三种元素的原子半径最大的是 (填元素符号);④号元素与⑧号元素形成化合物的电子式为 。
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分)下表为元素周期表的一部分,按要求完成各小题。
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
⑥ |
|
⑦ |
⑾ |
|
|
3 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
|
4 |
② |
④ |
|
|
|
|
⑨ |
|
1.化学性质最不活泼的元素 (填元编号,下同),非金属性最强的元素是 金属性最强的单质与水反应的离子方程式为
2.①③⑤三种元素的最高价氧化物水化物中,碱性最强的
3.①③⑤三种元素的原子半径由大到小的顺序为
4.某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为 在两种盐中该元素的化合价为 ,该元素的最高价氧化物和盐酸反应的化学方程式为 向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期第一次阶段性测试化学试卷(解析版) 题型:填空题
(16分) 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语
回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因 。 并写出电解时的电极反应式: 。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式 ,乙的结构式 ,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实 。(任举一例即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|
| |||||
|
|
|
| b | c | d |
|
|
| e |
| f |
|
| g |
|
|
(1) f元素在周期表中的位置是 周期 族。
(2) b元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,ca3的催化氧化反应的化学方程式为 ,若有1.25 mol 电子发生转移,则参加反应的ca3的体积为 L(标准状况)。
(5) a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式 。
(6) 由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com