
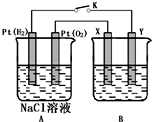
 ij��ѧ��ȤС������ͼ��ʾװ�ý��е绯ѧԭ����ʵ��̽�����ش��������⣺
ij��ѧ��ȤС������ͼ��ʾװ�ý��е绯ѧԭ����ʵ��̽�����ش��������⣺���� ��1�������ȼ�ϵ�أ��ұ��ǵ��أ�ͨ������һ��������������ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2H2O=4OH-��
��2��X���Դ����������������������������Ӧ���������Һ����������Һ��
��3����ͭ�к���Zn��Fe��Ag��Au�����ʣ�����п�������ڵ缫�Ϸŵ����������ӽ�����Һ���������������Ҫ�ɷ���Ag��Au��
��4����ⱥ��ʳ��ˮ������������ʧ�������������������������ӵõ������������������ݵ��ԭ����������д��ط�Ӧ���������ɵ������������������������Ũ�ȣ�������ӻ���������������Ũ�ȼ�����ҺpH���ָ���ҺŨ�����ݳ�ʲô����ʲô��ԭ�������
��5��X�缫����������������Ӧ���缫��ӦʽΪ��2Cu+2OH--2e-=Cu2O+H2O��
��6����Pt���缫����ⱥ����������Һʱ�����������������ӷŵ����������������������ӷŵ�����������ʵ�����ǵ���ˮ�������ܷ�Ӧ2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�������ˮ����Һ�������ƹ����͵����������壬ʣ��ĵ������Һ���DZ�����Һ�������������ƾ���͵���ˮ��ɵ�Ҳ�DZ�����Һ����������������ʽ���㼴�ɣ���д�缫����ʽʱҪע��缫�Ϸ����ķ�Ӧ�Լ���Һ������ԣ�
��� �⣺��1��A����ȼ�ϵ�أ�B���ǵ��أ�ͨ������һ��������������ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2H2O=4OH-��
�ʴ�Ϊ������O2+4e-+2H2O=4OH-��
��2��X���Դ����������������������������Ӧ������X�缫����Ϊ�����������Һ����������Һ��
�ʴ�Ϊ��Ag��AgNO3��Һ��
��3����ͭ�к���Zn��Fe��Ag��Au�����ʣ�����п�������ڵ缫�Ϸŵ����������ӽ�����Һ���������������Ҫ�ɷ���Ag��Au��
�ʴ�Ϊ��Ag��Au��
��4��Y�缫��ԭ��صĸ����������缫�����ӵõ�����������������������560ml�����ʵ���=$\frac{0.56L}{22.4L/mol}$=0.025mol�����ݵ�ⷽ��ʽ��
2Cl-+2H2O=H2��+Cl2��+2OH-��
1 2
0.025mol n
n=$\frac{0.025mol��2}{1}$=0.05mol
C��OH-��=$\frac{0.05mol}{0.5L}$=0.1mol/L��
C��H+��=10-13mol/L��pH=-lg[H+]=13������Ӧ����0.025mol��2=0.05mol��HCl�ָ�ԭ״̬��
�ʴ�Ϊ��13��0.05molHCl��
��5��X�缫����������������Ӧ���缫��ӦʽΪ��2Cu+2OH--2e-=Cu2O+H2O��
�ʴ�Ϊ��2Cu+2OH--2e-=Cu2O+H2O��
��6����Pt���缫����ⱥ����������Һʱ�����������������ӷŵ����������������������ӷŵ��������������ˮ����Һ�������ƹ����͵����������壬ʣ��ĵ������Һ���DZ�����Һ�������������ƾ���͵���ˮ��ɵ�Ҳ�DZ�����Һ��
N g Na2SO4•10H2O�����Ƶ�����=Ng��$\frac{142}{322}$=$\frac{71N}{161}$g��
����ˮ������Ϊxg��
2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2����
36g 2mol
x cmol
x=18cg
���Ա�����Һ����������=$\frac{\frac{71N}{161}}{N+18c}$��100%=$\frac{7100N}{161��N+18c��}$%��
��д�缫����ʽʱҪ�������������������ϲμӷ�Ӧ�����ʻ�������д��ͬʱҪע����Һ������ԶԵ缫����ʽ��Ӱ�죻
�ʴ�Ϊ��$\frac{7100N}{161��N+18c��}$%�����ݵ缫�Ϸ�����������ԭ��Ӧ�����Һ���������д��
���� ���⿼��ԭ��ء����ع���ԭ������ȷ�ƶ�ȼ�ϵ���������ǽⱾ��Ĺؼ����ѵ�����Һ��pH��������ʵ��������������ݵ�ⱥ��ʳ��ˮ�����ӷ���ʽ������𣬲����ڿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳���ǣ�Z��W��M��Y��X | |
| B�� | �⻯��Ļ�ԭ�ԣ�Y��M��W | |
| C�� | Y��M�������ﶼ������������ | |
| D�� | X2Z�ĵ���ʽΪ��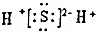 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �¶����ߣ����߶����� | |
| B�� | ������Ka��HCN����Ka��CH3COOH����˵��CH3COOH�ĵ����һ����HCN�� | |
| C�� | 2SO2��g��+O2��g��?2SO3��g��ƽ�������ѹǿ��ƽ�������ƶ�����Kֵ���� | |
| D�� | ��ѧƽ�ⳣ���Ĵ�С���¶ȡ�Ũ�ȡ��������й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������������� | |
| B�� | ��������̼���⡢�ȡ�������Ԫ����� | |
| C�� | ��������һ���л��� | |
| D�� | һ�����������ӹ�����24��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H3��Ħ��������3g | |
| B�� | H3����Ԫ�ص�һ���µ�ͬλ�� | |
| C�� | H3�������3������ | |
| D�� | H2��H3����Ԫ���γɵ����ֲ�ͬ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | ||
| C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�����Һ�м�����Ũ��Ϊ2 mol/L | |
| B�� | �����������й�ת��6Ħ������ | |
| C�� | ���õ���ͭ�����ʵ���Ϊ0.5Ħ�� | |
| D�� | ������Һ�е�pH=2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺
�������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com