
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:实验题
类比是一种重要的科学研究方法。某化学实验小组类比AgOH能溶于氨水的性质,猜测Cu(OH)2也具有同样的性质,并对此进行实验探究:
(1)写出AgOH与氨水反应的离子方程式_____________________________________。
(2)甲组同学进行如下操作:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成;继续滴加,观察现象,由此得出Cu(OH)2可溶于氨水的结论。
①写出生成蓝色沉淀的离子方程式:_______________________________________________
②写出向沉淀中滴加氨水的实验现象:______________________________________________
(3)乙组同学向CuSO4溶液中滴加NaOH溶液,制得Cu(OH)2悬浊液A,向其中加入足量氨水,始终未观察到(2)中的现象。甲乙两组同学在对他们的实验及现象进行比对后,决定对Cu(OH)2与氨水反应的机理进行探究:
①该实验小组的同学取一定量上述制得的Cu(OH)2悬浊液A,向其中加入足量饱和NH4Cl溶液,结果观察到(2)中现象。据此,有同学认为由于饱和NH4Cl溶液的加入引入了Cl—,致使Cu(OH)2与氨水的反应得以发生,而指导老师表示这一观点是不成立的。为了排除Cl—的干扰,该组同学又做了如下实验:取一定量上述制得的Cu(OH)2悬浊液A,向其中加入饱和___________溶液(填化学式),结果同样观察到(2)中的现象,据此可知该反应的发生与Cl—无关。
②因此,同学们又提出:Cu(OH)2与氨水的反应的发生需要NH4+的参与,于是同学们进一步探究:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成。通过离心的方法得到Cu(OH)2沉淀。将沉淀洗涤后,置于干燥洁净的试管中,向试管中滴加足量饱和氨水,为观察到(2)中现象,再向试管中滴加足量饱和NH4Cl溶液,观察到(2)中现象。
(i)检验是否沉淀洗涤干净的操作是___________________________________________
(ii)据此,可以得出结论:在Cu(OH)2与氨水的反应中,NH4+起着至关重要的作用,且________________对反应的发生有影响。
(4)试从溶解平衡角度解释上述反应发生过程中NH4+的作用:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.在原电池的正极和电解池的阳极上发生的都是氧化反应 |
| B.实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为2∶1 |
C.用铜作电极电解稀硫酸,可能发生反应:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| D.在用惰性电极电解稀硫酸的过程中,溶液pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Cu—Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是
①锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
②铜极反应:2H++2e-=H2↑,锌片溶解16.25g
③电流由铜极经导线流向锌极 ④溶液中SO42-移向铜极
| A.①④ | B.③④ | C.②③ | D.①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应: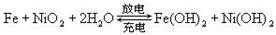
则下列有关对爱迪生蓄电池的推断错误的是
| A.放电时正极附近pH增大 |
B.充电时阴极的电极反应式为: 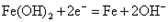 |
| C.放电时电解质溶液中的阴离子向正极方向移动 |
| D.蓄电池的电极可浸入某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是:( )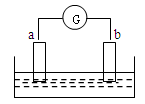
| A.a为负极,是铁片,烧杯中的溶液为硫酸 |
| B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C.a为正极,是碳棒,烧杯中的溶液为硫酸 |
| D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(8分)可以将氧化还原反应2H2+O2=2H2O设计成原电池。
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_________________________
___________;负极的电极反应式为__________________________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为________________________
_____________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com