合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N
2(g)+3H
2(g)?3NH
3(g),△H=-92.2kJ/mol.合成氨工业中原料气N
2可从空气中分离得到,H
2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是
加压有利于平衡正向移动,提高原料气的转化率
加压有利于平衡正向移动,提高原料气的转化率
.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是
增加反应速率,缩短达到平衡的时间
增加反应速率,缩短达到平衡的时间
.
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N
2、3n mol H
2,反应达平衡后测得平衡常数为K
1,此时N
2的转化率为x.则K和x的关系满足K=
.若温度为400℃,平衡常数为K
2,则K
1<
<
K
2(填“<”、“=”或“>”)
(3)甲烷在高温下与水蒸气反应反应方程式为:CH
4(g)+H
2O(g)=CO(g)+3H
2(g).部分物质的燃烧热数据如下表:
| 物 质 |
燃烧热(kJ?mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1mol H
2O(g)转变为1mol H
2O(l)时放出44.0kJ热量.
①写出CO燃烧的热化学方程式
CO(g)+
O
2(g)=CO
2(g)△H=-283.0kJ?mol
-1CO(g)+
O
2(g)=CO
2(g)△H=-283.0kJ?mol
-1.
②2H
2(g)+O
2(g)═2H
2O(g)△H=
-483.6
-483.6
kJ/mol.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.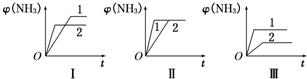
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.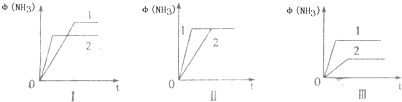
 H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发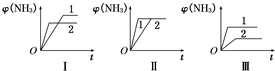 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.