
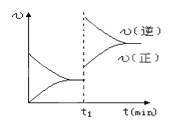
【题目】下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
A.2SO2(g)+O2(g)![]() 2SO3(g)△H<0
2SO3(g)△H<0
B.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H<0
4NO(g)+6H2O(g)△H<0
C.H2(g)+I2(g)![]() 2HI(g)△H>0
2HI(g)△H>0
D.N2(g)+3H2(g)![]() 2NH3(g)△H<0
2NH3(g)△H<0
【答案】B
【解析】
试题分析:有图像可知增大压强或升高温度后,V正、V逆都增大,由于V逆增大的多,所以平衡逆向移动。A.该反应的正反应为气体体积减小的放热反应。增大压强,平衡正向移动,升高温度,平衡逆向移动,与题意不符合。B。该反应的正反应为气体体积增大的放热反应。增大压强,化学平衡逆向移动;升高温度,化学平衡逆向移动,与题意相符合。正确。C.该反应是反应前后气体体积相等的可逆反应。正反应是吸热反应。增大压强,平衡不移动;升高温度,平衡正向移动,与题意不符合。错误。D.该反应的正反应为反应前后气体体积不等的吸热反应。增大压强,化学平衡不移动;升高温度,平衡正向移动。与题意不符合。错误。


科目:高中化学 来源: 题型:
【题目】铁在人体中的含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁,服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+![]() Fe3+的转化时,①中的Fe2+作 剂;
Fe3+的转化时,①中的Fe2+作 剂;
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作__________剂;
(3)用小苏打片(NaHCO3)治疗胃酸(主要成分盐酸)过多的离子方程式为 ;
如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
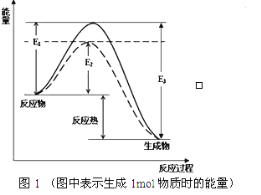
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
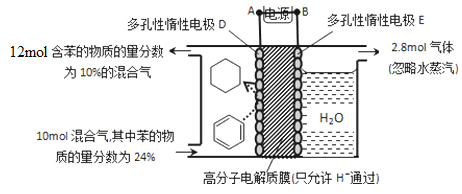
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但对维持生物体正常生命活动必不可少的一组元素是
A. C、Mn、Zn、Mg B. Zn、Cu、Mn、O
C. Zn、Cu、B、Mn D. Mg、Mn、Cu、H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸是常见的“三大酸”。现就三大酸与金属铜反应的情况,回答问题:
(1)稀盐酸不与Cu 反应,若在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为:____________________________。
(2)在一定体积的10mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积__________(填“大于”、“ 等于”或“小于”)180mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_____________________。
(3)镁铁混合物4.8g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2 .24LNO气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) ![]() 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________。
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”)。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,还需加入A、B。其中需加入A、B的物质的量分别是 _________________。
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是____________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器体积和温度都不变,向甲中加入一定量的A气体
D.保持容器体积和温度都不变,向甲中加入一定量的B气体
(5) 该温度下,向体积为1L的密闭容器中通入A、B、C、D气体物质的量分别为3mol、1mol、3mol、2mol,此时反应___________________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
CO2(g)+H2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )

A.反应CO(g)+H2O(g)![]() CO2(g)+H2(g) 的△H>0
CO2(g)+H2(g) 的△H>0
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com