
【题目】盐酸、硫酸和硝酸是常见的“三大酸”。现就三大酸与金属铜反应的情况,回答问题:
(1)稀盐酸不与Cu 反应,若在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为:____________________________。
(2)在一定体积的10mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积__________(填“大于”、“ 等于”或“小于”)180mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_____________________。
(3)镁铁混合物4.8g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2 .24LNO气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是_________克。
【答案】
(1)H2O2+Cu+2HCl = CuCl2+2H2O;
(2)大于;3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O;
(3)9.9g;
【解析】
试题分析:(1)过氧化氢在酸性环境下能够氧化铜生成铜离子,化学方程式:Cu+H2O2+2HCl=CuCl2+2H2O;故答案为:Cu+H2O2+2HCl=CuCl2+2H2O;
(2)铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则10molL-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则10molL-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)n(NO)=0.1mol,生成0.01mol NO,转移的电子的物质的量为:n(e-)=0.1mol×(5-2)=0.3mol,反应中存在:Mg→Mg2+→Mg(OH)2,Fe→Fe3+→Fe(OH)3,得出n(e-)=n(OH-),又m(沉淀)=m(混合物)+m(OH-),所以m(沉淀)=4.8g+0.3mol×17g/mol=9.9g,故答案为:9.9g。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】合金是建筑航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是________________,工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为______________。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________。焊接过程中使用的保护气为__________________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为_______________腐蚀。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 。
(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu—Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0 g,则合金中Cu的质量分数为___________________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有______________。
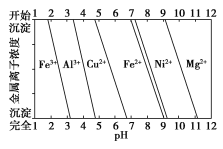
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于组成细胞的元素组成叙述正确的是( )
A. C元素因其在细胞的干重中含量最高,所以C是生命的最基本元素
B. C原子构成的碳链是蛋白质的骨架
C. 蛋白质和核酸中共有的元素是C、H、O
D. 构成细胞的微量元素就是指细胞中含量很少且可有可无的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
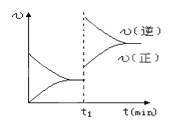
A.2SO2(g)+O2(g)![]() 2SO3(g)△H<0
2SO3(g)△H<0
B.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H<0
4NO(g)+6H2O(g)△H<0
C.H2(g)+I2(g)![]() 2HI(g)△H>0
2HI(g)△H>0
D.N2(g)+3H2(g)![]() 2NH3(g)△H<0
2NH3(g)△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中,属于核糖核酸(简称RNA)可能具有的生物学功能有
A. 降低化学反应的活化能 B. 所有病毒的遗传物质
C. 识别并转运氨基酸 D. 传递生物体遗传信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100 mLNa2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再加过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)原混合液Na2SO4的物质的量浓度?
(2)产生的气体在标准状况下的体积为?
(3)过滤出沉淀后,所得滤液的物质的量浓度(反应前后体积变化忽略不计)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 二氧化硫可以使溴水褪色是因为它有漂白性
B. 浓硫酸可用于干燥H2S和CO2
C. 可以用加热法除去NaCl固体中的混有的NH4Cl
D. 过量的Cu与浓硝酸反应不可能有一氧化氮生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]N、P、As都是同主族的元素。
(1)As基态原子的电子排布式为 。和砷位于同一周期,且未成对电子数也相同的元素还有 种。
(2)元素周期表中,与P紧邻的4种元素中电负性最强的是 (填元素符号),Si、P、S三元素第一电离能由大到小的顺序为 。
(3)NH3、PH3、AsH3三者的空间构型相同,都是 ,它们的沸点由高到低的顺序为 (填化学式)
(4)白磷是由P4分子形成的分子晶体,每个P4分子是正四面体结构(如图)。

P的杂化方式为 。白磷易溶于CS2,难溶于水,原因是 。
(5)采用GaxIn(1-x)As(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn(1-x)As立方体形晶胞中每1个顶点和面心都有1个原子,晶胞内部有4个原子,则该晶胞中含有 个砷原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com