
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一。下列说法正确的是( )
A. 乙烯可与乙醇发生酯化反应
B. 乙烯可使酸性KMnO4溶液褪色
C. 一定条件下乙烯可发生聚合反应
D. 一定条件下乙烯可发生加成反应
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 硅是良好的半导体材料,且是制造光缆的主要材料
B. SiO2不溶于水,也不溶于任何酸
C. 观察K2SO4的焰色应透过蓝色的钴玻璃
D. Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中Fe也显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
早期发现的一种天然二十面体准晶颗粒由三种Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为_______________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为_______________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙醛分子中各元素的电负性由大到小的顺序为_______________。乙酸的沸点明显高于乙醛,其主要原因是_____________________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为__________。列式表示Al单质的密度_______________ g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A.5 min时该反应的K值一定小于12 min时的K值
B.0~5 min内,v(H2)=0.05 mol/(L·min)
C.10 min时,改变的外界条件可能是减小压强
D.该反应混合气体的平均相对分子质量:5 min时小于12 min 时的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)现代化学中,常利用_________上的特征谱线来鉴定元素
(2)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释为什么与水结构十分相似的OF2的极性很小?______________________。
(3)己知H2S2O8的结构如图。
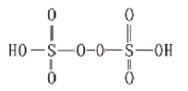
①H2S2O8硫原子的轨道杂化方式为________________。上述反应中被还原的元素为_____________。
②S基态原子中电子的空间运动状态有________________ 种。
③上述反应每生成1 mol MnO4-,S2O82-断裂的共价键类型及其数目为___________、__________。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。
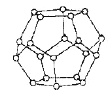
①如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为__________;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是__________。
(5)底心晶胞的特征是:将晶胞的框架的顶角移至晶胞的某一对面的中心所得的新晶胞与原晶胞无差别。在晶体学上底心平移的符号是+ (1/2,1/2,0) (C底心);或+ (0,1/2,1/2) (A底心);或+ (1/2,0,1/2) (B底心)。底心平移是指其中之一。

则:I2是_______(填“A”、“B”或“C”)底心晶胞.
(6)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图(a)所示,并给出了一个石墨的六方晶胞如图(b)所示。
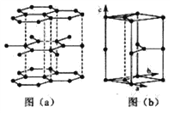
①在图中画出晶胞沿C轴的投影(用“●” 标出碳原子位置即可)_______________;
标出碳原子位置即可)_______________;
②假设石墨的层间距为300 pm。C-C键长为150 pm。计算石墨晶体的密度为______g· cm-3(碳元素的相对质量为12,NA=6.0×1023,计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应速率和化学平衡的分析中,不正确的是
①在一密闭容器中充入1 mol H2和1 mol I2,达到平衡后,保持恒压,向其中再加入1 mol H2和1 mol I2,重新达到平衡时,反应速率增大
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,升高温度,可以增大正反应速率,减小逆反应速率
2NH3(g) △H<0,升高温度,可以增大正反应速率,减小逆反应速率
③在2 L密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),达到平衡时,C的浓度为0.6 mol/L,则A的转化率为30%
2C(g),达到平衡时,C的浓度为0.6 mol/L,则A的转化率为30%
④Mg、Al在相同条件下分别与0.1 mol/L盐酸反应,反应速率相同
A.①② B.①②③ C.②③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com