
【题目】现有①CaCl2②金刚石③NH4Cl④Na2SO4⑤干冰⑥MgO⑦CH4⑧SiO2八种物质,按要求回答下列问题(填序号):
(1)属于原子晶体的化合物是_____,只有离子键的物质是_____。
(2)含有共价键的离子化合物是_____,晶体微粒以分子间作用力结合的是_____。
(3)①的电子式是_____,⑤的电子式是_____。
【答案】⑧ ![]()
![]()
![]()
![]()
![]()
【解析】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。含有离子键的化合物是离子化合物,原子间通过共价键形成的空间网状结构的晶体是原子晶体,分子间通过分子间作用力形成的晶体是分子晶体,据此解答。
①CaCl2中只有离子键,形成的是离子晶体;
②金刚石中含有共价键,形成的是原子晶体;
③NH4Cl中含有离子键和极性键,形成的是离子晶体;
④Na2SO4中含有离子键和极性键,形成的是离子晶体;
⑤干冰中只有极性键,形成的是分子晶体;
⑥MgO中含有离子键,形成的是离子晶体;
⑦CH4中只有极性键,形成的是分子晶体;
⑧SiO2中只有极性键,形成的是原子晶体;
(1)综上所述属于原子晶体的化合物是⑧,只有离子键的物质是①⑥。
(2)含有共价键的离子化合物是③④,晶体微粒以分子间作用力结合的是⑤⑦。
(3)氯化钙中含有离子键,电子式是![]() ,二氧化碳中含有极性键,电子式是
,二氧化碳中含有极性键,电子式是![]() 。
。


科目:高中化学 来源: 题型:
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
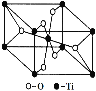
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
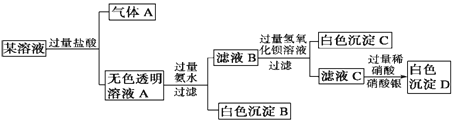
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对σ键和π键的认识不正确的是
A. 分子中只要含有共价键,则至少含有一个σ键
B. s﹣sσ键、p﹣pσ键与s﹣pσ键都是轴对称的
C. p﹣pσ键和p﹣pπ键的重叠方式是相同的
D. 含有π键的分子在反应时,π键是化学反应的积极参与者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐(NaCl)是生活中常用的调味品,胃酸的主要成分是盐酸。下列关于两种物质的说法正确的是( )
A. 炒菜时放入食盐并不破坏NaCl中的化学键
B. 胃舒平(主要成分氢氧化铝)与胃酸反应生成的AlCl3属于离子化合物
C. NaCl熔化时破坏共价键
D. 盐酸中的溶质HCl属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、C、D、E、G、X、Y、Z是几种常见的短周期主族元素,其原子半径随原子序数变化如下图所示。已知C的最高正价与最低负价的绝对值相等;E的一种核素的质量数为18,中子数为10;G原子和Ne原子的核外电子数相差1;X的简单离子半径在同周期中最小;Y的单质是一种常见的半导体材料;Z的最外层有7个电子。回答下列问题:

(1)C在元素周期表中的位置_____,由A、E两种元素组成的18电子微粒的结构式为_________。
(2)E、G、Z三种元素的简单离子半径最小的是_____(填离子符号)。
(3)元素的非金属性:C_____Y(填“>”或“<”),其实验依据是_____(用离子方程式表示 )
(4)X的原子结构示意图为_____。
(5)Y与Z形成的化合物在一定条件下与足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是( )
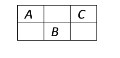
A. B为第二周期的元素
B. C为VA族元素
C. 三种元素都为非金属元素
D. B是三者中化学性质最活泼的非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
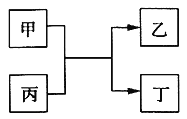
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
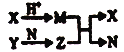
A. 相对分子质量M>N,沸点M>N B. 简单离子半径:D>B>C>A
C. Z 为 Na2CO3 D. 图中有两个氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com