
【题目】A、C、D、E、G、X、Y、Z是几种常见的短周期主族元素,其原子半径随原子序数变化如下图所示。已知C的最高正价与最低负价的绝对值相等;E的一种核素的质量数为18,中子数为10;G原子和Ne原子的核外电子数相差1;X的简单离子半径在同周期中最小;Y的单质是一种常见的半导体材料;Z的最外层有7个电子。回答下列问题:

(1)C在元素周期表中的位置_____,由A、E两种元素组成的18电子微粒的结构式为_________。
(2)E、G、Z三种元素的简单离子半径最小的是_____(填离子符号)。
(3)元素的非金属性:C_____Y(填“>”或“<”),其实验依据是_____(用离子方程式表示 )
(4)X的原子结构示意图为_____。
(5)Y与Z形成的化合物在一定条件下与足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是_____。
【答案】第二周期ⅣA族 H-O-O-H Na+ > SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3- 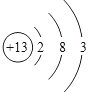 SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
【解析】
A、C、D、E、G、X、Y、Z是几种常见的短周期主族元素,A的原子序数和原子半径均是最小的,则A是H。已知C的最高正价与最低负价的绝对值相等,位于第ⅣA,原子序数小于D和E,但原子半径大于D和E,则C是碳;E的一种核素的质量数为18,中子数为10,质子数是18-10=8,为O,则D是N;G原子和Ne原子的核外电子数相差1,原子半径最大,则G是Na;X的简单离子半径在同周期中最小,原子序数大于Na,则X是Al;Y的单质是一种常见的半导体材料,Y是Si;Z的最外层有7个电子,原子序数最大,则Z是Cl,据此解答。
根据以上分析可知A、C、D、E、G、X、Y、Z分别是H、C、N、O、Na、Al、Si、Cl。则
(1)碳元素在元素周期表中的位置第二周期第ⅣA族,由A、E两种元素组成的18电子微粒是双氧水,其结构式为H-O-O-H。
(2)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则E、G、Z三种元素的简单离子半径最小的是Na+。
(3)同主族从上到下非金属性逐渐减弱,则元素的非金属性:C>Si,碳酸能制备硅酸可以说明,反应的离子方程式为SiO32-+H2O+CO2=H2SiO3↓+CO32-;
(4)X是Al,原子结构示意图为 。
。
(5)Y与Z形成的化合物在一定条件下与足量水反应,生成一种弱酸和一种强酸,根据原子守恒可知应该是硅酸和盐酸,则该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
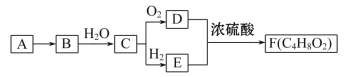
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·L-1,C能发生银镜反应,F为有浓郁香味、不易溶于水的油状液体。
请回答:
(1)有机物D中含有的官能团名称是________;有机物B的结构简式是________。
(2)C→D的反应方程式是________________________________。
(3)C→E的反应类型是____________
A、加成反应 B、取代反应 C、氧化反应 D、还原反应
(4)下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①CaCl2②金刚石③NH4Cl④Na2SO4⑤干冰⑥MgO⑦CH4⑧SiO2八种物质,按要求回答下列问题(填序号):
(1)属于原子晶体的化合物是_____,只有离子键的物质是_____。
(2)含有共价键的离子化合物是_____,晶体微粒以分子间作用力结合的是_____。
(3)①的电子式是_____,⑤的电子式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升。关于该反应的下列叙述①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。其中正确的是

A. ①②③ B. ①③ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com