
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下(已知:TiO2+易水解,只能存在于强酸性溶液中):
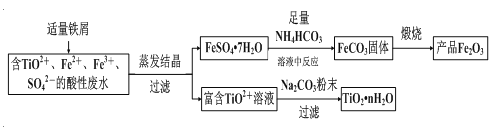
(1)富含TiO2+溶液中加入Na2CO3粉末能得到固体TiO2nH2O,其原理是______________。
(2)制取FeCO3发生的化学方程式为______________________;反应温度一般需控制在35℃以下,其目的是______________。
(3)已知Ksp[Fe(OH)2]=8×10-16。制取FeCO3时,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中______(填“有”或“没有”)Fe(OH)2;煅烧中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________。
(4)为了控制NH4HCO3用量需要测定固体中FeSO47H2O的含量。称1g固体样品,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol·L-1KMnO4标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
MnO4-(紫红)+5Fe2++8H+=Mn2+(粉红)+5Fe3++4H2O
5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
①H3PO4的作用____________。②样品中FeSO47H2O的含量为___________%。
【答案】因为发生水解反应:TiO2++(n+1)H2O![]() TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑ 防止NH4HCO3分解或减小Fe2+水解 没有 向反应容器中补充适量空气(氧气) 消除Fe3+的颜色干扰 2.78V
TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑ 防止NH4HCO3分解或减小Fe2+水解 没有 向反应容器中补充适量空气(氧气) 消除Fe3+的颜色干扰 2.78V
【解析】
钛矿工业中的酸性废水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等离子,加入铁粉还原铁离子得到亚铁离子,通过蒸发浓缩、冷却结晶过滤洗涤、干燥得到硫酸亚铁晶体,配制成溶液调节溶液pH5~5.8范围内,加入足量碳酸氢铵,过滤得到碳酸亚铁沉淀,在坩埚中灼烧得到氧化铁,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O![]() TiO2nH2O+2H+向生成TiO2nH2O的方向移动,可得到TiO2粗产品。
TiO2nH2O+2H+向生成TiO2nH2O的方向移动,可得到TiO2粗产品。
(1)富含TiO2+溶液中加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平TiO2++(n+1)H2O![]() TiO2nH2O+2H+向生成TiO2nH2O的方向移动;
TiO2nH2O+2H+向生成TiO2nH2O的方向移动;
(2)制取FeCO3中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应温度一般需控制在35°C以下,是为了避免温度过高碳酸氢铵分解,减少亚铁离子的水解程度;
(3)根据溶液中c(Fe2+)·c(OH-)2与Ksp[Fe(OH)2]比较,可判断有无Fe(OH)2沉淀,保证二价铁被氧化为三价需要多通入空气或氧气;
(4)①根据反应方程式及高锰酸钾的物质的量计算出产品中FeSO4.7H2O的质量分数;
②根据题给信息判断。
(1)富含TiO2+溶液中加入Na2CO3粉末与溶液中的H+反应,降低了溶液中c(H+),使平TiO2++(n+1)H2O![]() TiO2nH2O+2H+,向生成TiO2nH2O的方向移动,可得到TiO2粗产品,故答案为:因为发生水解反应:TiO2++(n+1)H2O
TiO2nH2O+2H+,向生成TiO2nH2O的方向移动,可得到TiO2粗产品,故答案为:因为发生水解反应:TiO2++(n+1)H2O![]() TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动;
TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动;
(2)制取FeCO3中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑反应温度一般需控制在35°C以下,是为了避免温度过高碳酸氢铵分解,减少亚铁离子的水解程度,故答案为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑;避免温度过高碳酸氢铵分解,减少亚铁离子的水解程度;
(3)室温下测得溶液的pH为8.5,由题中数据可知,溶液中c(Fe2+)·c(OH-)2=1x10-6×(1×10-5.5)=10-17<Ksp[Fe(OH)2]=8x10-16,故无Fe(OH)2沉淀生成;煅烧中,为了得到较为纯净的Fe2O3,需要将亚铁完全氧化为三价铁,除了适当的温度外,还需要采取的措施是向反应容器中补充适量空气(氧气),故答案为:没有;向反应容器中补充适量空气(氧气);
(4)①铁离子颜色呈黄色,干扰终点判断,而5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+,消除了铁离子干扰,故答案为:消除Fe3+的颜色干扰;
②待测液消耗的高锰酸钾的物质的量为:0.02mol/L×VmL×10-3L/mL=2V×10-5mol,根据反应:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,硫酸亚铁的物质的量为:2V×10-5mol×5=V×10-4mol,所以样品中含有的FeSO47H2O的质量为:278g/mol×V×10-4mol=2.78V×10-2g,FeSO47H2O的质量分数为:![]() =2.78V%;
=2.78V%;
故答案为:2.78V。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
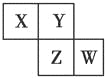
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 氢化物的稳定性:X>Y>Z
D. 四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
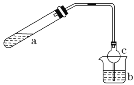
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是______。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_____________________。
(3)实验中加热试管a的目的是:
①_____________________________________________________;
②______________________________________________________。
a中反应的化学方程式:__________________________________。
(4)球形干燥管c的作用是_________________________________, b烧杯中加有饱和Na2CO3溶液,其作用是_____________________。
(5)若反应前向b中加入几滴酚酞,溶液呈红色,反应结束后b中的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )
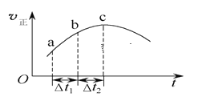
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O![]() 3H++HSO4- +2I- 、I-+I2
3H++HSO4- +2I- 、I-+I2![]() I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(
I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(![]() )的变化如图所示:
)的变化如图所示:
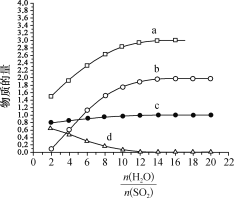
图中表示的微粒:a为_____________,d为____________________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应 HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
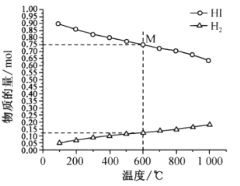
①该反应的△H __________________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ______MPa,反应的平衡常数Kp=_____________ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____________ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ________(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2.
8Cu+4FeO+2Fe2O3+16SO2.
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是__(注明试剂、现象).
(3)上述冶炼过程产生大量SO2.下列处理方案中合理的是__(填代号)
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是__.
(5)实验室制备,收集干燥的SO2,所需仪器如下.

①其中装置A产生SO2,反应的化学方程式为__.
②请按气流方向连接各仪器接口,顺序为a→__→ → → f,装置E中NaOH溶液的作用是__.E中反应的离子方程式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体中可能含有Na+、K+、Al3+、Ba2+、SO42-、CO32-、SiO32-、等离子,将其配成 100mL 溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)配制100mL 溶液需要使用容量瓶,该仪器使用前必须进行的一步操是______________;在“定容”操作中,当液面接近容量瓶刻度线1~2cm 处,改用__________________,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(2)若出现如下情况,导致所配溶液浓度偏高的是_____________________
A.称量时砝码已经生锈;
B.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作;
C.定容时俯视;
D.定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出;
E.容量瓶不干燥,含有少量蒸馏水。
(3) 根据以上实验可得出:一定存在的离子是_________________,,一定不存在的离子是___________________。
(4) 加入稀盐酸,所发生的离子反应方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com