
【题目】热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O![]() 3H++HSO4- +2I- 、I-+I2
3H++HSO4- +2I- 、I-+I2![]() I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(
I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(![]() )的变化如图所示:
)的变化如图所示:
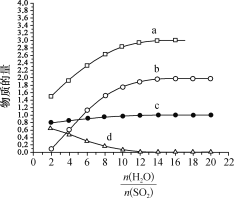
图中表示的微粒:a为_____________,d为____________________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应 HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
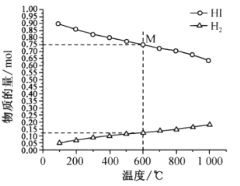
①该反应的△H __________________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ______MPa,反应的平衡常数Kp=_____________ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____________ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ________(用含k1、k-1、k2…的代数式表示)。
【答案】H+ I3- > 0.0125 ![]() (或0.167) 吸收
(或0.167) 吸收 ![]() c(H2)·c(I2)
c(H2)·c(I2)
【解析】
(1)加水稀释,SO2+I2+2H2O![]() 3H++HSO4-+2I-正向移动,I-+I2
3H++HSO4-+2I-正向移动,I-+I2![]() I3-逆向移动,同时,加水稀释后HSO4- 电离程度增大,结合图中信息,可确定曲线a表示H+、曲线b表示I-、曲线c表示HSO4-、曲线d表示I3-。从而得出图中表示的微粒:a为H+,d为I3-。答案为:H+;I3-;
I3-逆向移动,同时,加水稀释后HSO4- 电离程度增大,结合图中信息,可确定曲线a表示H+、曲线b表示I-、曲线c表示HSO4-、曲线d表示I3-。从而得出图中表示的微粒:a为H+,d为I3-。答案为:H+;I3-;
(2) ①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应,该反应的△H>0。答案为:>;
②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压p(I2)=![]() MPa=0.0125MPa,反应HI(g)
MPa=0.0125MPa,反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数Kp=
I2(g)的平衡常数Kp=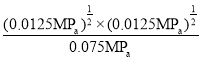 =
=![]() (或0.167)。答案为:0.0125;
(或0.167)。答案为:0.0125;![]() (或0.167);
(或0.167);
(3)①第一步反应断裂共价键,吸收能量。答案为:吸收;
②反应速率由慢反应决定,即v=k3c(H2I)·c(I),
第一步是快速平衡,k1c(I2)=k-1c2(I),可得c2(I)=![]() c(I2),
c(I2),
第二步也是快速平衡,k2c(I)·c(H2)=k-2c(H2I),可得c(H2I)=![]() c(H2)·c(I),
c(H2)·c(I),
v=k3![]() c(H2)·c(I)·c(I)= k3
c(H2)·c(I)·c(I)= k3![]() c(H2)·
c(H2)·![]() c(I2)=
c(I2)=![]() c(H2)·c(I2)。答案为:
c(H2)·c(I2)。答案为:![]() c(H2)·c(I2)。
c(H2)·c(I2)。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
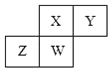
A. 原子半径:Z>W>X>Y
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. ZY2晶体熔化、液态Y3气化均需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等[来源:Z
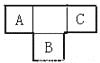
(1)写出元素的符号: A________、B_________、C_________;
(2)B元素位于元素周期表中第__________周期,第_________族。
(3)C的原子结构示意图为___________,用电子式表示C的单质与H2反应的过程_____________。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
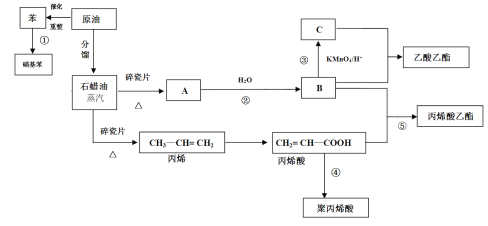
(1)C的结构简式为________。
(2)丙烯酸中含氧官能团的名称为_____________。
(3)③④反应的反应类型分别为_____________、___________。
(4)写出下列反应方程式
①反应①的化学方程式____________;
②反应②的化学方程式_________________;
③反应⑤的化学方程式____________。
(5)丙烯酸(CH2 = CH — COOH)可能发生的反应有_______________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(6)丙烯分子中最多有______个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。下列说法错误的是( )
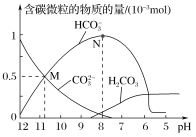
A.HCl溶液滴加一半时,溶液pH>7
B.H2CO3的Ka1的数量级为10-6
C.pH=8时,溶液中NaHCO3的物质的量浓度为0.1 mol·L-1
D.在M点:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下(已知:TiO2+易水解,只能存在于强酸性溶液中):
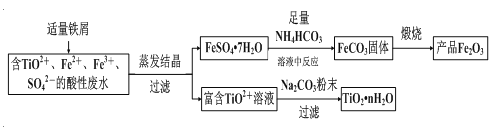
(1)富含TiO2+溶液中加入Na2CO3粉末能得到固体TiO2nH2O,其原理是______________。
(2)制取FeCO3发生的化学方程式为______________________;反应温度一般需控制在35℃以下,其目的是______________。
(3)已知Ksp[Fe(OH)2]=8×10-16。制取FeCO3时,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中______(填“有”或“没有”)Fe(OH)2;煅烧中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________。
(4)为了控制NH4HCO3用量需要测定固体中FeSO47H2O的含量。称1g固体样品,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol·L-1KMnO4标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
MnO4-(紫红)+5Fe2++8H+=Mn2+(粉红)+5Fe3++4H2O
5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
①H3PO4的作用____________。②样品中FeSO47H2O的含量为___________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
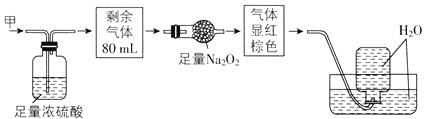
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:OH-、Na+、CrO![]() 、SO
、SO![]()
B.c(S2O![]() )=0.1mol·L-1的溶液中:Na+、K+、CO
)=0.1mol·L-1的溶液中:Na+、K+、CO![]() 、SO
、SO![]()
C.水电离出的c(H+)=1.0×10-13mol·L-1的溶液中:Na+、Mg2+、HSO![]() 、NO
、NO![]()
D.能使蓝色石蕊试纸变红的溶液中:Na+、NH![]() 、
、 、Cl-
、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com