
【题目】25 ℃时,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。下列说法错误的是( )
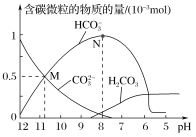
A.HCl溶液滴加一半时,溶液pH>7
B.H2CO3的Ka1的数量级为10-6
C.pH=8时,溶液中NaHCO3的物质的量浓度为0.1 mol·L-1
D.在M点:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
【答案】C
【解析】
不加酸时,Na2CO3溶液显碱性,随着HCl溶液的加入,溶液由碳酸钠转变为碳酸氢钠,当HCl溶液滴加一半时,两者恰好生成碳酸氢钠,再继续加HCl溶液,溶液逐步由碳酸氢钠转化为碳酸,由此分析。
A.当HCl溶液滴加一半时,两者恰好生成碳酸氢钠,溶液中,以NaHCO3为主,故该溶液呈碱性,溶液pH>7,故A正确;
B.由图中可以看出,当c(H+)=106mol/L时,c(H2CO3)=c(HCO![]() ),H2CO3的Ka1=
),H2CO3的Ka1=![]() ,故B正确;
,故B正确;
C.从图中可知当pH值为8时,溶液中的主要溶质为NaHCO3。当加入盐酸的体积为10mL时,恰好生成NaHCO3,此时NaHCO3的物质的量浓度为0.05mol/L,故C错误;
D.由图可知M点的CO32-和HCO3-物质的量相等,两者的盐水解溶液呈碱性,pH值为11呈碱性,故离子浓度为:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+),故D正确;
)>c(OH-)>c(H+),故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
A.在35℃,纯水中C(H+)>C(OH-)
B.水的电离度α(25℃)>α(35℃)
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
D.某温度下纯水中C(H+) 为2×10-7mol/L,则此时的C(OH-) 也为2×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是

A.该电池工作时,CO32-通过隔膜移动到b极
B.若a极消耗1mol碳粉,转移电子数为4NA
C.b极的电极反应式为2CO2+O2-4e-=2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C6H12O2)具有果香味,可用作食品加香剂,还可用作天然和合成树脂的溶剂。

已知:① D、E具有相同官能团,E的相对分子质量比D大;
② E分子含有支链;
③ F是可以使溴的四氯化碳溶液褪色的烃。
(1) B的化学名称为____________;D的结构简式_____________。
(2) C、F分子中所含的官能团的名称分别是___________、______________。
(3) 写出有机物B生成C的化学反应方程式:___________________;反应类型是________。
(4) 写出有机物B与E反应生成A的化学反应方程式:_______________________;反应类型是________。
(5) E的同分异构体中能同时满足下列条件的共有________种(不含立体异构) ,并写出任意一种符合条件的同分异构体结构简式__________________。
①能与Na反应; ②能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,下列说法不正确的是( )
A.常温常压下,30 g乙烷气体中所含有的共价键数目为6NA
B.含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为l.5NA
D.在电解精炼铜的过程中,当阴极析出32g铜单质时,电子转移数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O![]() 3H++HSO4- +2I- 、I-+I2
3H++HSO4- +2I- 、I-+I2![]() I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(
I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(![]() )的变化如图所示:
)的变化如图所示:
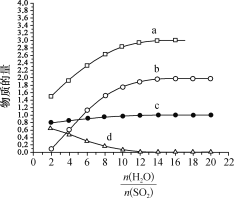
图中表示的微粒:a为_____________,d为____________________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应 HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
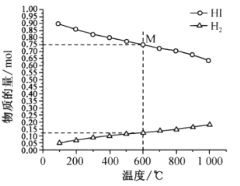
①该反应的△H __________________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ______MPa,反应的平衡常数Kp=_____________ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____________ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ________(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5gZn放入足量的盐酸中,锌完全反应。计算:
(1)6.5gZn的物质的量?_________。
(2)参加反应的HCl的物质的量?_________。
(3)生成氢气的体积(标准状况)?__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com