
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
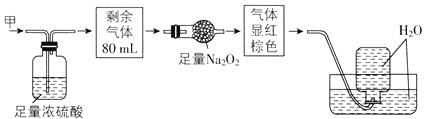
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】一种从冶铅废渣中提取铅的工艺流程如图所示:

已知:醋酸铅易溶于水,难电离。火法炼铅是将方铅矿(主要成分为PbS)在空气中焙烧,生成PbO和SO2。
回答下列问题:
(1)用方铅矿火法炼铅的反应的化学方程式为______。
(2)火法炼铅的废气中含SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____。
(3)冶铅废渣用硫酸洗涤后,生成的PbSO4表面常含有铜单质,为了溶解铜单质,常需要同时加入一定量的H2O2溶液,写出溶解铜单质发生反应的离子方程式_______;为加快此反应的速率,下列方法合理的是_____(填标号)。
A.搅拌 B.适当加热 C.减压
(4)将饱和Na2CO3溶液加入滤渣1中发生的反应为![]() (aq)+PbSO4(s)
(aq)+PbSO4(s)![]() PbCO3(s)+
PbCO3(s)+![]() (aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(5)工业上常用等体积的饱和NaHCO3溶液代替饱和Na2CO3溶液,将一定量的PbSO4转化为PbCO3。PbSO4与NaHCO3或Na2CO3的物质的量之比不同时,PbSO4的转化率如表所示。
Ⅰ | n(PbSO4)∶n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 98 | 98 | 98 |
依据表中数据,物质的量之比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:
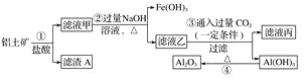
请回答下列问题:
(1)请写主要成份的化学式:滤渣A________,滤液丙中的溶质是NaCl和________。
(2)反应②中Al3+反应的离子方程式为_________________;反应③的离子方程式为____________;反应④的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。下列说法正确的是
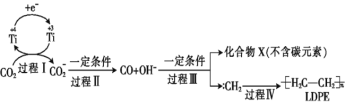
A. 含![]() 的-极与电源负极相连
的-极与电源负极相连
B. 过程Ⅰ、Ⅱ中碳元素均被还原,过程Ⅲ中碳元素被氧化
C. 电解过程中CO![]() 向阴极迁移
向阴极迁移
D. 工业上生产1.4×104 g的LDPE,转移电子的物质的量为6×103 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
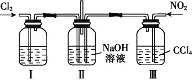
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,不能达到实验目的的是( )

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸发KCl溶液制备无水KCl
C. 用图3所示装置可以完成“喷泉”实验
D. 用图4所示装置制取干燥纯净的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等温、等容条件下,有下列气体反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2 mol/L和6 mol/L。下列叙述正确的是 ( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2 mol/L和6 mol/L。下列叙述正确的是 ( )
A.达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A)
B.达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同
C.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同
D.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。
(5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。
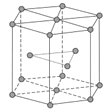
(6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
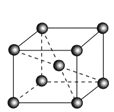
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分。其合成路线如下(部分条件已略):
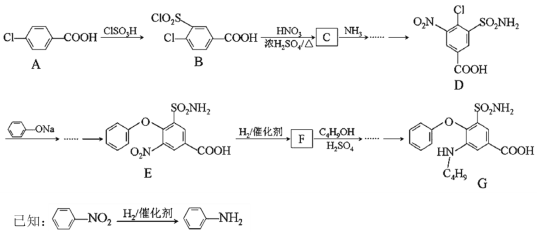
回答下列问题:
(1)A的化学名称______,A中的官能团_______。
(2)A→B的反应类型______,E→F的反应类型_______。
(3)D的分子式_____,F的结构简式_______。
(4)B→C的化学反应方程式________。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为________(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)以甲苯(其他无机试剂任选)为原料合成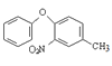 的合成路线为_______。
的合成路线为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com