
【题目】一种从冶铅废渣中提取铅的工艺流程如图所示:

已知:醋酸铅易溶于水,难电离。火法炼铅是将方铅矿(主要成分为PbS)在空气中焙烧,生成PbO和SO2。
回答下列问题:
(1)用方铅矿火法炼铅的反应的化学方程式为______。
(2)火法炼铅的废气中含SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____。
(3)冶铅废渣用硫酸洗涤后,生成的PbSO4表面常含有铜单质,为了溶解铜单质,常需要同时加入一定量的H2O2溶液,写出溶解铜单质发生反应的离子方程式_______;为加快此反应的速率,下列方法合理的是_____(填标号)。
A.搅拌 B.适当加热 C.减压
(4)将饱和Na2CO3溶液加入滤渣1中发生的反应为![]() (aq)+PbSO4(s)
(aq)+PbSO4(s)![]() PbCO3(s)+
PbCO3(s)+![]() (aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(5)工业上常用等体积的饱和NaHCO3溶液代替饱和Na2CO3溶液,将一定量的PbSO4转化为PbCO3。PbSO4与NaHCO3或Na2CO3的物质的量之比不同时,PbSO4的转化率如表所示。
Ⅰ | n(PbSO4)∶n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 98 | 98 | 98 |
依据表中数据,物质的量之比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是______。
【答案】2PbS+3O2![]() 2PbO+2SO2 2NH3·H2O+SO2 = 2
2PbO+2SO2 2NH3·H2O+SO2 = 2![]() +
+![]() +H2O Cu+H2O2+2H+ = Cu2++2H2O AB PbCO3
+H2O Cu+H2O2+2H+ = Cu2++2H2O AB PbCO3![]() PbO+CO2↑、2PbO+C
PbO+CO2↑、2PbO+C![]() 2Pb+CO2↑(或PbO+C
2Pb+CO2↑(或PbO+C![]() Pb+CO↑) 物质的量之比相同时,Na2CO3溶液中c(
Pb+CO↑) 物质的量之比相同时,Na2CO3溶液中c(![]() )比NaHCO3溶液中的大
)比NaHCO3溶液中的大
【解析】
冶铅废渣用硫酸洗涤,生成PbSO4,滤渣1为PbSO4,加入饱和碳酸钠溶液,PbSO4转化为PbCO3,滤渣2为PbCO3,加入醋酸溶液,PbCO3溶解,得到醋酸铅溶液,和锌发生置换反应得到海绵铅,洗涤干燥后得到粗铅。
(1)由火法炼铅是将方铅矿在空气中焙烧,生成PbO和SO2,可知发生反应的化学方程式为2PbS+3O2![]() 2PbO+2SO2。
2PbO+2SO2。
(2)SO2与过量的氨水反应生成亚硫酸铵,反应的离子方程式为2NH3·H2O+SO2 = 2![]() +
+![]() +H2O。
+H2O。
(3)酸性条件下铜被H2O2氧化为Cu2+,反应的离子方程式是Cu+H2O2+2H+ = Cu2++2H2O;搅拌能加快反应速率,适当升高温度可使反应速率加快,该反应没有气体参与,减压对反应速率无影响,故选AB。
(4)以PbCO3和焦炭为原料制备Pb的反应的化学方程式为PbCO3![]() PbO+CO2↑、2PbO+C
PbO+CO2↑、2PbO+C![]() 2Pb+CO2↑(或PbO+C
2Pb+CO2↑(或PbO+C![]() Pb+CO↑)。
Pb+CO↑)。
(5)物质的量之比相同时,Na2CO3溶液中c(![]() )比NaHCO3溶液中的大,故Ⅱ中PbSO4的转化率比Ⅰ中的略大。
)比NaHCO3溶液中的大,故Ⅱ中PbSO4的转化率比Ⅰ中的略大。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】向20mL0.5mol·L-1的醋酸溶液中逐滴加入一定物质的量浓度的烧碱溶液,混合溶液的温度与所加NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
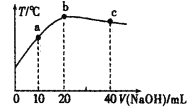
A.a点:c(CH3COOH)>c(OH-)+c(Na+)
B.醋酸的电离常数:b点<a点
C.b点:c(CH3COOH)+c(CH3COO-)=0.5mol·L-1
D.c点:n(OH-)-n(H+)-n(CH3COOH)=0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
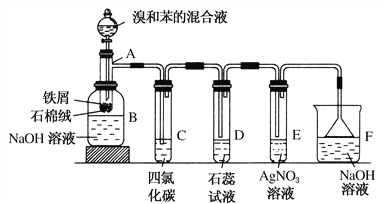
填写下列空白:
①试管A中的反应方程式为_____________________________________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D和E两试管,看到的现象为:________________________________。
写出E中反应的离子方程式__________________________________________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是___________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
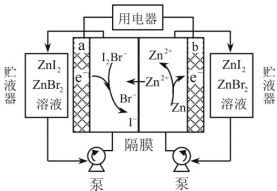
下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①②④B.①③④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式均为C5H10O2的两种有机物的结构简式如右图所示:
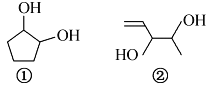
下列说法正确的是
A. 二者都能使Br2的CCl4溶液褪色
B. ①②分子中所有原子均可能处于同一平面
C. 等质量的①和②分别与足量钠反应生成等质量的H2
D. 与其互为同分异构体的酯有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
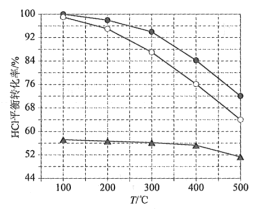
可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
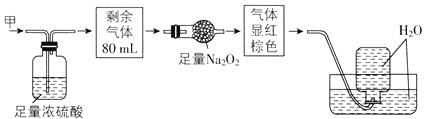
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com