
【题目】向20mL0.5mol·L-1的醋酸溶液中逐滴加入一定物质的量浓度的烧碱溶液,混合溶液的温度与所加NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
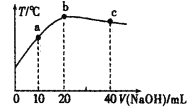
A.a点:c(CH3COOH)>c(OH-)+c(Na+)
B.醋酸的电离常数:b点<a点
C.b点:c(CH3COOH)+c(CH3COO-)=0.5mol·L-1
D.c点:n(OH-)-n(H+)-n(CH3COOH)=0.01mol
【答案】D
【解析】
根据图示,当加入NaOH溶液的体积为20mL时,温度最高,酸碱完全中和,可确定NaOH溶液的浓度也为0.5mol·L-1,加入NaOH溶液的体积小于20mL时,溶液为醋酸和醋酸钠的混合溶液,当加入NaOH溶液的体积大于20mL时,溶液为NaOH溶液和醋酸钠的混合溶液,据此分析解答。
A.a点为等浓度的醋酸和醋酸钠的混合溶液,溶液中存在物料守恒:2c(Na+)=c(CH3COOH)+c(CH3COO-),电荷守恒:c(Na+)+ c(H+)= c(CH3COO-)+c(OH-),变形为:c(CH3COO-)=c(Na+)+c(H+)-c(OH-),代入物料守恒可得:c(CH3COOH)+ c(H+)=c(OH-)+c(Na+),则c(CH3COOH)<c(OH-)+c(Na+),故A错误;
B.醋酸属于弱电解质,部分电离,电离过程为吸热的过程,升高温度,醋酸的电离平衡正向移动,促进醋酸的电离,电离平衡常数增大,根据图示,温度:b点>a点,则醋酸的电离平衡常数:b点>a点,故B错误;
C.b点时加入的氢氧化钠为20mL,且反应温度最高,酸碱恰好完全中和,溶液为醋酸钠溶液,溶液中存在物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-),根据分析,NaOH溶液的浓度也为0.5mol·L-1,当等体积混合后,溶液体积变为40mL,此时溶液中c(Na+)=![]() =0.25 mol·L-1,c(CH3COOH)+c(CH3COO-)=0.25mol·L-1,故C错误;
=0.25 mol·L-1,c(CH3COOH)+c(CH3COO-)=0.25mol·L-1,故C错误;
D.c点时加入的氢氧化钠为40mL,反应后溶液为等浓度的NaOH溶液和醋酸钠的混合溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为:c(Na+)=2c(CH3COOH)+2c(CH3COO-),两式合并可得:c(OH-)-c(H+)-c(CH3COOH)= c(CH3COOH)+c(CH3COO-),同一溶液中溶液的体积相同,则n(OH-)-n(H+)-n(CH3COOH)= n(CH3COOH)+n(CH3COO-),n(CH3COOH)+n(CH3COO-)即为溶液中醋酸的总物质的量为0.5mol·L-1×0.02L=0.01mol,则n(OH-)-n(H+)-n(CH3COOH)=0.01mol,故D正确;
答案选D。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

(1)该密闭容器的容积是___。
(2)达到未平衡状态的时刻是___min(填“3”或“10”)。
(3)在前3min内,用H2浓度的变化表示的反应速率v(H2)=___mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为__。
(5)达平衡后H2O(g)的物质的量分数是___。
(6)已知:①CO(g)+2H2(g)=CH3OH(g) △H=-90.1kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式__,反应在10min内所放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法其中正确的是( )
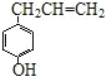
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它存在能发生银镜反应的同分异构体;④1mol该化合物最多可与4mol H2发生加成反应
A.①③B.①②④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油、天然气目前依然是我国的主要能源。它们在氧气不足时会不完全燃烧:2C+O2 ![]() 2CO,烃在氧气不足时也会不完全燃烧。
2CO,烃在氧气不足时也会不完全燃烧。
(1)完成下列方程式:2CxHy +___O2 ![]() aCO +___CO2 +___H2O
aCO +___CO2 +___H2O
(2)H 原子的电子排布式是“1s1”,它未表明电子运动状态的方面是________(填编号)。
a. 电子层 b. 电子亚层 c. 电子云的伸展方向 d. 电子的自旋
(3)上述反应中半径最大的原子核外有______种能量不同的电子,写出其最外层轨道表示式______。
(4)石油和煤的綜合利用中,下列说法错误的是______。
a.近年我国在新疆等地发现的石油矿藏超几十亿吨说明石油取之不尽
b.石油裂解目的是提高汽油的产量和质量
c.煤的液化和煤的气化都属于化学变化、石油的减压分馏属于物理変化
d.石油、煤、天然气都可以通过管道运输节约运输成本
(5)碳元素与氧元素的非金属性强弱的是 C______O(填“>”或“<”)。
(6)写出一个事实比较碳与硫非金属性强弱______。
(7)煤的气化是煤高效洁净利用的方向之一。在一定温度下的恒容密闭容器中建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)—Q,该反应的平衡常数表达式______,可认定该可逆反应在一定条件下已达到化学平衡状态的 是______ 。(选填序号)
a. 体系的压强不再发生变化 b. 生成 n mol CO 的同吋生成 n mol H2
c. v 正(CO)=v 逆(H2) d. 1mol H-H 键断裂同吋断裂 1mol H-O 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1molH2(g)中的H-H键需要消耗436kJ能量,如图反应3H2(g)+N2(g) ![]() 2NH3(g)的能量变化示意图.下列说法不正确的是
2NH3(g)的能量变化示意图.下列说法不正确的是

A. 断开1 mol N2(g)中的N![]() N键要吸收941 kJ能量
N键要吸收941 kJ能量
B. 生成2mol NH3(g)中的N-H键吸收2346 kJ能量
C. 3H2(g) + N2(g) ![]() 2NH3(g) △H=-97
2NH3(g) △H=-97![]()
D. NH3(g) ![]() 3/2H2(g) +1/2 N2(g) △H=48.5
3/2H2(g) +1/2 N2(g) △H=48.5 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中: Fe2+,NO3-,SO42-,Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+,K+,Cl-,HCO3-
C.![]() =1012的溶液中:NH4+,Al3+,NO3-,Cl-
=1012的溶液中:NH4+,Al3+,NO3-,Cl-
D.c(Fe3+) =0.1 mol·L-1的溶液中:K+,ClO-,SO42-,SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从冶铅废渣中提取铅的工艺流程如图所示:

已知:醋酸铅易溶于水,难电离。火法炼铅是将方铅矿(主要成分为PbS)在空气中焙烧,生成PbO和SO2。
回答下列问题:
(1)用方铅矿火法炼铅的反应的化学方程式为______。
(2)火法炼铅的废气中含SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____。
(3)冶铅废渣用硫酸洗涤后,生成的PbSO4表面常含有铜单质,为了溶解铜单质,常需要同时加入一定量的H2O2溶液,写出溶解铜单质发生反应的离子方程式_______;为加快此反应的速率,下列方法合理的是_____(填标号)。
A.搅拌 B.适当加热 C.减压
(4)将饱和Na2CO3溶液加入滤渣1中发生的反应为![]() (aq)+PbSO4(s)
(aq)+PbSO4(s)![]() PbCO3(s)+
PbCO3(s)+![]() (aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(5)工业上常用等体积的饱和NaHCO3溶液代替饱和Na2CO3溶液,将一定量的PbSO4转化为PbCO3。PbSO4与NaHCO3或Na2CO3的物质的量之比不同时,PbSO4的转化率如表所示。
Ⅰ | n(PbSO4)∶n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 98 | 98 | 98 |
依据表中数据,物质的量之比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com