
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法其中正确的是( )
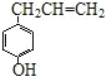
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它存在能发生银镜反应的同分异构体;④1mol该化合物最多可与4mol H2发生加成反应
A.①③B.①②④C.②③D.②③④
【答案】D
【解析】
该分子中含有苯环、酚羟基和碳碳双键,具有酚、苯和烯烃的性质,能发生取代反应、加成反应、氧化反应等,据此分析解答。
①该化合物中含有C.H、O元素,所以不属于芳香烃,属于烃的含氧衍生物,①项错误;
②苯环、碳碳双键上碳原子能共面,碳碳单键能旋转,所以分子中至少有7个碳原子处于同一平面,②项正确;
③该分子中含有碳碳双键和O原子,所以其同分异构体中可能含有醛基,所以它的部分同分异构体能发生银镜反应,③项正确;
④1mol该化合物中的苯环最多和3mol氢气发生加成反应,碳碳双键和1mol氢气发生加成反应,则1mol该化合物最多可与4mol H2发生加成反应,④项正确;
②③④项符合题意,D项正确,
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)CO2催化加氢制甲醇的有关反应及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | ||
500℃ | 700℃ | 800℃ | |
Ⅰ.H2(g)+CO2(g) H2O(g)+CO(g) | 1.0 | 1.70 | 2.52 |
Ⅱ.2H2(g)+CO(g) CH3OH(g) | 2.5 | 0.34 | 0.15 |
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH | |||
①ΔH___0(填“>”、“<”或“=”)。
②已知反应Ⅲ的速率方程式:υ正=k正·c3(H2)·c(CO2),υ逆=k逆·c(CH3OH)·c(H2O),k正、k逆为速率常数。反应达到平衡后,仅升高温度,k正增大的倍数___k逆增大的倍数(填“大于”、“小于”或“等于”)。
③500℃时,向恒容的密闭容器中加入1molCO2和1molH2,控制反应条件只发生反应Ⅰ。达到平衡后,只改变下列条件,能使CO的平衡体积分数增大的是___(填选项字母)。
A.增大压强 B.降低温度 C.再通入等物质的量CO2和H2 D.分离出部分水
(2)在200℃时,向5L带气压计的恒容密闭容器中通入2molCO2和2molCH4发生反应CH4(g)+CO2(g)2H2(g)+2CO(g),测得初始压强为P0kPa,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。
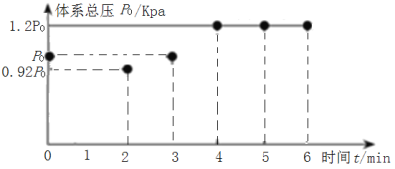
①该反应过程中从0min到2min压强变化原因是___。
②0~4min内,反应的平均反应速率υ(CO2)=___。
③用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[气体分压(p分)=气体总压(p总)×气体体积分数]
(3)科学家提出利用CO2与CH4制备“合成气”(CO、H2)可能的反应历程如图所示。
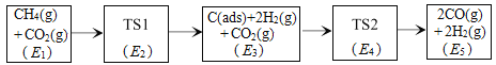
注:C(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量[如第一个方框中1个CH4(g)+1个CO2(g)的相对总能量为E1eV,单位:eV]。其中,TS表示过渡态。
①CH4(g)+CO2(g) 2H2(g)+2CO(g)ΔH=___kJ·mol-1(已知:1eV=1.6×10-22kJ)
②若E4+E1<E3+E2,则决定制备“合成气”反应速率的反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸是一种绿色生态杀菌剂,结构简式为 ,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
A.过氧化氢的电子式![]()
B.乙酸溶于水:CH3COOH=CH3COO-+H+
C.过氧乙酸中含有极性共价键和非极性共价键
D.制备过氧乙酸的化学反应方程式:CH3COOH+H2O2![]() CH3COOOH+H2O
CH3COOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助太阳能将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是
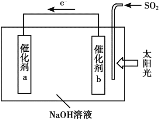
A. 该装置可将太阳能转化为化学能
B. 催化剂b附近的溶液pH增大
C. 吸收1mol SO2,理论上能产生1mol H2
D. 催化剂a表面发生的反应为:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质.
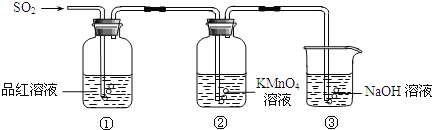
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是 .
(2)当观察到②中溶液颜色变浅时,①中的现象是 .
(3)装置③的作用是 .
(4)①、②中的现象说明二氧化硫具有的性质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL0.5mol·L-1的醋酸溶液中逐滴加入一定物质的量浓度的烧碱溶液,混合溶液的温度与所加NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
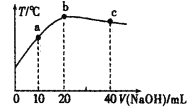
A.a点:c(CH3COOH)>c(OH-)+c(Na+)
B.醋酸的电离常数:b点<a点
C.b点:c(CH3COOH)+c(CH3COO-)=0.5mol·L-1
D.c点:n(OH-)-n(H+)-n(CH3COOH)=0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.在标准状况下,78.0 g苯中含有碳碳双键的数目为3NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.在标准状况下,2.24 L CHCl3中所含碳氢键的数目为0.1NA
D.0.1 molL-1的Na2CO3溶液中,![]() 的数目小于0.1NA
的数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
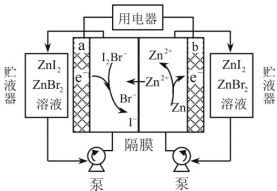
下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com