
【题目】借助太阳能将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是
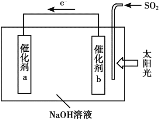
A. 该装置可将太阳能转化为化学能
B. 催化剂b附近的溶液pH增大
C. 吸收1mol SO2,理论上能产生1mol H2
D. 催化剂a表面发生的反应为:2H2O+2e-=H2↑+2OH-
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
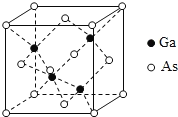
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
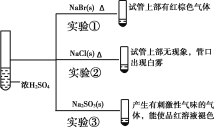
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法其中正确的是( )
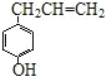
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它存在能发生银镜反应的同分异构体;④1mol该化合物最多可与4mol H2发生加成反应
A.①③B.①②④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
A. 反应①和②均为氧化还原反应
B. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应①中每生成1 mol Na2CrO4时转移电子3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com