
����Ŀ��������G��ij�ֵͶ�����ҩ����Ҫ�ɷ֡���ϳ�·������(������������)��
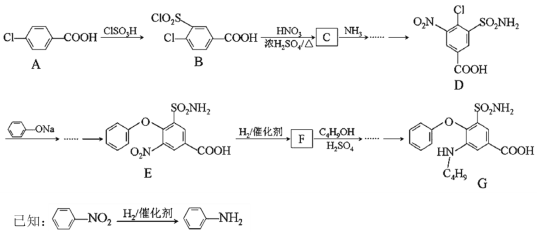
�ش��������⣺
(1)A�Ļ�ѧ����______��A�еĹ�����_______��
(2)A��B�ķ�Ӧ����______��E��F�ķ�Ӧ����_______��
(3)D�ķ���ʽ_____��F�Ľṹ��ʽ_______��
(4)B��C�Ļ�ѧ��Ӧ����ʽ________��
(5)��G�����������۷�Ӧ�������۲�������ڽṹΪ________(дһ��)��
(6)C4H9OH��ͬ���칹�������ڴ�����___�֣����к˴Ź�������ͼ����������ͬ���칹��Ľṹ��ʽΪ___��
(7)�Լױ�(�������Լ���ѡ)Ϊԭ�Ϻϳ�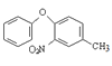 �ĺϳ�·��Ϊ_______��
�ĺϳ�·��Ϊ_______��
���𰸡����ȱ����� ��ԭ�ӡ��Ȼ� ȡ����Ӧ ��ԭ��Ӧ C7H5O6N2Cl 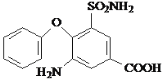
 +HNO3
+HNO3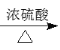
 +H2O
+H2O 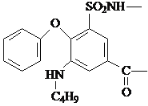 ��
��  4
4 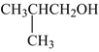
��������
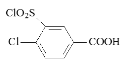
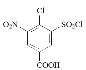
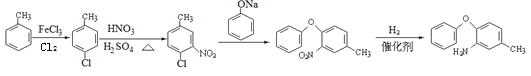
������л���ת����ϵ��֪�� ![]() ��ClSO3H����ȡ����Ӧ����
��ClSO3H����ȡ����Ӧ����![]() ������D�Ľṹ��ʽ��֪����Ũ���������£�
������D�Ľṹ��ʽ��֪����Ũ���������£�![]() ��Ũ���ᷢ��������Ӧ����
��Ũ���ᷢ��������Ӧ����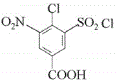 ����CΪ
����CΪ ��
�� �백������ȡ����Ӧ����
�백������ȡ����Ӧ����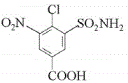 ��
�� ��
��![]() ����ȡ����Ӧ����
����ȡ����Ӧ����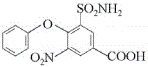 ���������Ϣ��֪���ڴ��������£�
���������Ϣ��֪���ڴ��������£�  ������������ԭ��Ӧ����
������������ԭ��Ӧ����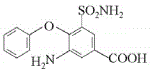 ����F��
����F�� ��һ�������£�
��һ�������£� ��C4H9OH����ȡ����Ӧ����
��C4H9OH����ȡ����Ӧ����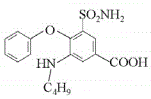 ��
��
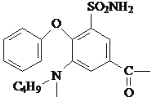
��1��A�Ľṹ��ʽΪ![]() ��������Ϊ��ԭ�ӡ��Ȼ�������Ϊ���ȱ����ᣬ�ʴ�Ϊ�����ȱ������ԭ�ӡ��Ȼ���
��������Ϊ��ԭ�ӡ��Ȼ�������Ϊ���ȱ����ᣬ�ʴ�Ϊ�����ȱ������ԭ�ӡ��Ȼ���
(2)A��B�ķ�ӦΪ![]() ��ClSO3H����ȡ����Ӧ����
��ClSO3H����ȡ����Ӧ����![]() ��E��F�ķ�ӦΪ�ڴ��������£�
��E��F�ķ�ӦΪ�ڴ��������£�  ������������ԭ��Ӧ����
������������ԭ��Ӧ���� ���ʴ�Ϊ��ȡ����Ӧ����ԭ��Ӧ��
���ʴ�Ϊ��ȡ����Ӧ����ԭ��Ӧ��
(3)D�Ľṹ��ʽΪ ������ʽC7H5O6N2Cl��F�Ľṹ��ʽΪ
������ʽC7H5O6N2Cl��F�Ľṹ��ʽΪ ���ʴ�Ϊ��C7H5O6N2Cl��
���ʴ�Ϊ��C7H5O6N2Cl�� ��
��
(4)B��C�ķ�ӦΪ��Ũ���������£�![]() ��Ũ���ᷢ��������Ӧ����
��Ũ���ᷢ��������Ӧ���� ����Ӧ�Ļ�ѧ��Ӧ����ʽΪ
����Ӧ�Ļ�ѧ��Ӧ����ʽΪ +HNO3
+HNO3
 +H2O���ʴ�Ϊ��
+H2O���ʴ�Ϊ�� +HNO3
+HNO3
 +H2O��
+H2O��
��5��һ�������£��������Ȼ��ܷ�����ˮ��Ӧ�����ļ��� �����к��а������Ȼ���һ���������ܷ������۷�Ӧ���ɸ߾���߾�������ڽṹΪ
�����к��а������Ȼ���һ���������ܷ������۷�Ӧ���ɸ߾���߾�������ڽṹΪ ��
��  ��
��
��6��C4H9OH��ͬ���칹�������Ӵ�����1-������2-������2-��-1-������2-��-2-��������4�֣����к˴Ź�������ͼ����������ͬ���칹��Ľṹ��ʽΪ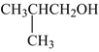 ��
��
��7���������Ϣ��֪���Լױ�(�������Լ���ѡ)Ϊԭ�Ϻϳ�![]() �IJ���Ϊ�����Ȼ��������������£�
�IJ���Ϊ�����Ȼ��������������£�![]() ����������ȡ����Ӧ����
����������ȡ����Ӧ����![]() ����Ũ���������£�
����Ũ���������£�![]() ��Ũ���Ṳ�ȷ���������Ӧ����
��Ũ���Ṳ�ȷ���������Ӧ���� ��
�� ��
��![]() ����ȡ����Ӧ����
����ȡ����Ӧ���� ���ڴ��������£�
���ڴ��������£�  ������������ԭ��Ӧ����
������������ԭ��Ӧ���� ���ϳ�·��Ϊ��
���ϳ�·��Ϊ��  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ�Ļ��������п��ܺ���NO��CO2��NO2��NH3��N2�еļ��֣���100mL���������ͼ��ʾʵ�鴦��������õ�������Һ��������������ʣ�࣬���������ɿ���Ϊ( )
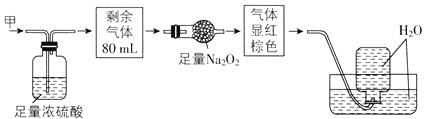
A.NO2��NH3��N2B.NH3��NO��CO2
C.NH3��NO2��CO2D.NO��CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ĵ����Ų�ʽ������Ų�ͼ�������������ԭ�����ǣ� ��
A.![]() B.
B.![]()
C.F![]() D.Na+
D.Na+![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ���������Ѽ���)��
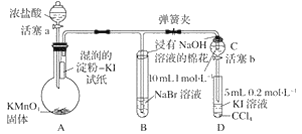
ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��.����
��1����֤������������ǿ�ڵ��ʵ��������_________________________________________��
��2��B����Һ������Ӧ�����ӷ���ʽ��____________________________________________��
��3��Ϊ��֤���������ǿ�ڵ⣬�������IJ�����������________________________________��
��4��������ʵ���Ŀ����_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����д��ȷ���ǣ�������
A. H2SO4��Һ��Ba��OH��2��Һ��Ӧ��Ba2++OH��+H++![]() ��BaSO4��+H2O
��BaSO4��+H2O
B. ��NaͶ�뵽CuSO4��Һ�У�2Na+Cu2+===2Na++Cu��
C. ����ʯ���ڴ����У�CaCO3+2CH3COOH===Ca2++2CH3COO��+CO2��+H2O
D. ��Cl2ͨ��ˮ�У�Cl2+H2O===2H++Cl��+ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2������)Ϊ��Ҫԭ����������ԭ�Ϻ췯��(��Ҫ�ɷ�Na2Cr2O7��2H2O)������Ҫ�����������£�
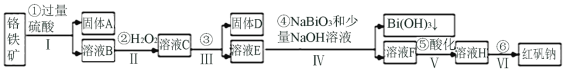
�������ϵ�֪��
���������£�NaBiO3������ˮ����ǿ�����ԣ��ڼ��������£��ܽ�Cr3+ת��Ϊ![]() ��
��
����
�������� | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
��ʼ������pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
������ȫ��pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
�ش��������⣺
(1)Fe��Ԫ�����ڱ��е�λ��______________________________����Ӧ֮ǰ�Ƚ���ʯ�����Ŀ����__________________��
(2)����ۼӵ��Լ�Ϊ_____________����ʱ��ҺpHҪ����5��Ŀ��______________��
(3)д����Ӧ�ܵ����ӷ�Ӧ����ʽ______________________��
(4)�����ữ��ʹ![]() ת��Ϊ
ת��Ϊ![]() ��д���÷�Ӧ�����ӷ���ʽ_________________��
��д���÷�Ӧ�����ӷ���ʽ_________________��
(5)����ҺH��������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ����T�ú췯�ƴ־��壬���ƺ췯����Դ־�����Ҫ���õIJ�����__________________(���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2018��10��15�գ��й��á����������ҡ����ػ���ɹ��ԡ�һ��˫�ǡ���ʽ���䱱������ȫ����������ϵͳ��15��16�����ǣ������ƽ���Ϊ������泥�NH4ClO4���ȡ��Ʊ�NH4ClO4�Ĺ����������£�
����ʳ��ˮ![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
����˵���������
A. NH4ClO4�������ӻ�����
B. �ܽ�ȣ�NaClO4��NH4ClO4
C. ���NaClO3��Һʱ������ӦʽΪClO3-��H2O��2e-=C1O4-��2H+
D. �������п�ѭ�����õ�������NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KMnO4����������Һ����Ӧ����ʽ��2KMnO4+16HCl===2KCl+2MnCl2+5Cl2��+8H2O����������Cl2�ڱ�״�������Ϊ56 L�����㣺
(1)�μӷ�Ӧ��HCl�����ʵ���________________
(2)��Ӧ�б�������HCl�����ʵ���__________________
(3)����˫���ű������ת�Ƶķ������Ŀ___________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������NO2��SO2���巢����Ӧ��NO2��g��+SO2��g��![]() SO3��g��+NO��g����H=��41.8kJ��mol-1����NO2��SO2�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����
SO3��g��+NO��g����H=��41.8kJ��mol-1����NO2��SO2�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����
A.���������ɫ���ֲ���B.��ϵѹǿ���ֲ���
C.SO3��NO������ȱ��ֲ���D.ÿ����1 mol SO3��ͬʱ����1 mol NO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com