
【题目】利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。
【答案】 (3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O O2 4.0×10-11 14.71 2H++ZnS=H2S↑+Zn2+ 冷却结晶 Zn(OH)2 2PbO2+2H2SO4=2PbSO4+O2↑+2H2O
【解析】试题分析:(1)粗锌中的铜与混酸的稀溶液反应,铜被氧化成+2价的铜离子,硝酸被还原成+2价的一氧化氮,反应为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O。气体X为一氧化氮,补充氧气在溶液中可发生4NO+O2+2H2O=4HNO3,全部转化成硝酸循环使用,能够体现绿色化学思想;
(2)固体B为氢氧化铜沉淀,固体C含氢氧化铁沉淀,若溶液I中c(Cu2+)为0.05molL-1,根据c(Cu2+)×c2(OH-)>Ksp[Cu(OH)2[,c2(OH-)=5×1020/5×102,c(OH-)=1×10-9mol/L,要得到固体氢氧化铁根据c(Fe3+)×c3(OH-)>Ksp[Fe(OH)3],c(Fe3+)>4×1016/(1×109)3=4×10-11mol/L;
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2molL-1稀硝酸中,而最终为氢氧化物,故沉淀质量为金属质量加上金属阳离子结合氢氧根质量,氢氧根物质的量与金属失电子物质的量相等,而电子与硝酸根结合生成NO,故有氢氧根物质的量为![]() =0.3mol,所以总质量为9.61g+0.3mol×17g/mol=14.71g;若固体A是另一种物质,取部分固体C于试管中,加入足量的盐酸,有臭鸡蛋气味的气体产生,气体为硫化氢,该实验为制备硫酸锌,所以阳离子为锌,阴离子为硫,和盐酸反应生成硫化氢的物质为硫化锌,反应为2H++ZnS=H2S↑+Zn2+;
=0.3mol,所以总质量为9.61g+0.3mol×17g/mol=14.71g;若固体A是另一种物质,取部分固体C于试管中,加入足量的盐酸,有臭鸡蛋气味的气体产生,气体为硫化氢,该实验为制备硫酸锌,所以阳离子为锌,阴离子为硫,和盐酸反应生成硫化氢的物质为硫化锌,反应为2H++ZnS=H2S↑+Zn2+;
(4)溶液Ⅲ为硫酸锌溶液,制备七水合硫酸锌,防止结晶水失水,需冷却结晶,溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液,铵根离子水解抑制锌离子水解,因氢氧化锌的Ksp小于硫化锌,用Na2S溶液作为反应物,制得的ZnS含有较多的杂质Zn(OH)2;
(5)铅蓄电池放电时,Pb作负极、PbO2作正极,负极上Pb失电子与硫酸根离子结合生成PbSO4,反应式为Pb+SO42--2e-=PbSO4,正极上PbO2得电子和硫酸根、氢离子反应生成PbSO4和H2O,正极反应式为:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑,铅蓄电池不使用时,正极PbO2与硫酸发生还原反应,Pb(+4→+2),O(-2→0),发生氧化还原反应的方程式为2PbO2+2H2SO4=2PbSO4+O2↑+2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)虚线框内的实验装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,化学反应方程式是 ,该反应属于四种基本反应类型中的 _______反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

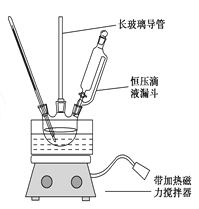
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是_______________________。
(2)第1次过滤时滤渣的主要成分有__________、__________(填化学式,下同),第3次过滤时滤渣的成分是__________。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为__________h;铝的浸取率与![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在![]() 相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。
相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。

(4)流程中循环使用的物质有__________。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,请简要说明该过程能够发生的原因____________________。
(6)用粉煤灰制取含铝化合物的主要意义是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用。有机物M是中药狼把草的成分之一,其结构如图所示。下列叙述不正确的是( )

A.M是芳香族化合物,它的分子式为C9H6O4
B.1 mol M最多能与3 mol Br2发生反应
C.1 mol M最多能与含有3 mol NaOH的溶液发生反应
D.在一定条件下能发生取代、加成、水解、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl 。
下列说法不正确的是( )

A. 腐蚀过程中,负极 a被氧化
B. 环境中的Cl-扩散到孔口,并与正极反应产物和负极
反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C. 若生成 2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448L
D. 正极的电极反应式为: 正极反应是 O2+ 4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)A和B中含有的官能团名称分别为___ _____,____________。
(2)写出A的结构简式:____________ ___________。
(3)①③的反应类型分别为______ __反应和____ ____反应。
(4)写出乙醇的同分异构体的结构简式:______________ ______。
(5)写出反应②和③的化学方程式:
②____________________________;④_____________________________。
(6)写出B与新制Cu(OH)2悬浊液反应的化学方程式:_____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学生活与技术]以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:

请回答下列问题:
(1)在炉气制造中,生成SO2的化学方程式为_________________________________________;
(2)炉气精制的作用是将含SO2的炉气________、________及干燥,如果炉气不经过精制,对SO2催化氧化的影响是___________________________________________;
(3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如下图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是____________。

(4)在SO2催化氧化设备中设置热交换器的目的是________,从而充分利用能源。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com