


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、乙烯使溴的四.氯化碳溶液褪色;苯使溴水褪色 |
| B、乙酸与氢氧化钠溶液反应;乙酸制乙酸乙酯 |
| C、乙醇使酸性高锰酸钾溶液褪色;葡萄糖与新制Cu(OH)2悬浊液共热得砖红色沉淀 |
| D、苯制溴苯;氯乙烯制塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 苯甲酸甲酯 | |
| 熔点/℃ | -12.3 |
| 沸点/℃ | 199.6 |
| 密度/g?cm-3 | 1.0888 |
| 水溶性 | 不溶 |
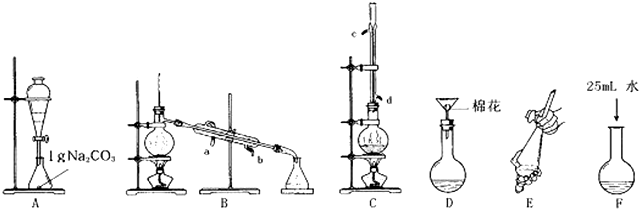

查看答案和解析>>
科目:高中化学 来源: 题型:
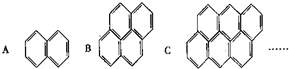 在沥青蒸气里含有多种稠环芳香烃,如图所示A、B、C …,
在沥青蒸气里含有多种稠环芳香烃,如图所示A、B、C …,查看答案和解析>>
科目:高中化学 来源: 题型:
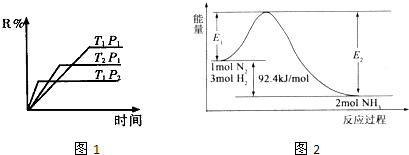
查看答案和解析>>
科目:高中化学 来源: 题型:
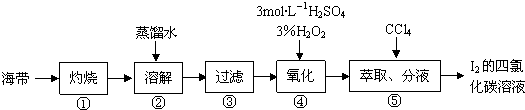
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
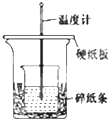 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如| A、烧杯间填满碎纸条的作用是固定小烧杯 |
| B、图中装置还需要增加一根玻璃棒进行搅拌 |
| C、量取NaOH溶液的体积时仰视进行操作,会使测出的中和热数值偏高 |
| D、若改用60 mL 0.55 mol/L盐酸与40 mL 0.50 mol/L的NaOH溶液进行反应,从理论上讲测出的中和热不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com