
| 苯甲酸甲酯 | |
| 熔点/℃ | -12.3 |
| 沸点/℃ | 199.6 |
| 密度/g?cm-3 | 1.0888 |
| 水溶性 | 不溶 |
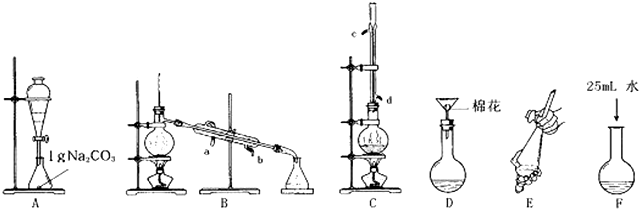



科目:高中化学 来源: 题型:
| A、石油属于可再生矿物能源 |
| B、石油分馏的各馏分均是纯净物 |
| C、石油的裂化是物理变化 |
| D、石油主要含有碳、氢两种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实 验 操 作 | 实验现象 | 结 论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 将一定量的NaNO3和KCl混合液加热浓缩至有固体析出,过滤 | 得到白色晶体 | 白色晶体为KNO3 |
| C | 向某FeCl2溶液中,加入Na2O2粉末 | 得红褐色沉淀 | 原FeCl2已氧化变质 |
| D | 向浓度均为0.1mol/L NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
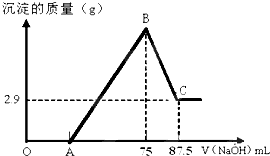 将一定量镁和铝的混合粉末加入50mL未知浓度的硫酸中,搅拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的体积与产生沉淀的量如下图所示,请回答下列问题:
将一定量镁和铝的混合粉末加入50mL未知浓度的硫酸中,搅拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的体积与产生沉淀的量如下图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
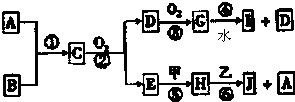
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染 |
| B、油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量 |
| C、为了防止食品受潮变质,常在食品包装袋中放入活性铁粉 |
| D、用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com