
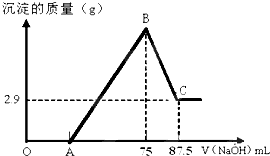
 将一定量镁和铝的混合粉末加入50mL未知浓度的硫酸中,搅拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的体积与产生沉淀的量如下图所示,请回答下列问题:
将一定量镁和铝的混合粉末加入50mL未知浓度的硫酸中,搅拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的体积与产生沉淀的量如下图所示,请回答下列问题:| 2.9g |
| 58g/mol |
| 0.075L×8mol/L |
| 2×0.05L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、除去Na2CO3 固体中混有的少量的NaHCO3:置于坩埚中加热 |
| B、除去FeCl3酸性溶液中少量的FeCl2,加稍过量的双氧水后放置 |
| C、除去乙酸乙酯中混有的少量乙酸,加入乙醇并加热 |
| D、除去CO2中混有的少量的HC1:通过饱和的NaHCO3溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量 铁粉 | ||
| ② | 加入少量Na2O2粉末 | ||
| ③ | 加入少量AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 苯甲酸甲酯 | |
| 熔点/℃ | -12.3 |
| 沸点/℃ | 199.6 |
| 密度/g?cm-3 | 1.0888 |
| 水溶性 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com