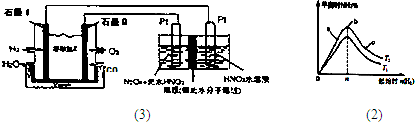
(2010?石景山区一模)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠.设计装置如下:(忽略装置中空气的影响)
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O.
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O.
.
(2)猜测B中可以观察的主要现象是
溶液逐渐变蓝
溶液逐渐变蓝
.C瓶出来的气体是
NO
NO
.
(3)已知:①室温下存在反应3HNO
2=HNO
3+2NO↑+H
2;②在酸性溶液中,NO
2-可将MnO
4-还原为Mn
2+且无气体生成.写出检验D中产物是亚硝酸钠的方法:
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠
.
(4)E装置的作用是
吸收D中未反应完的NO,以免污染空气
吸收D中未反应完的NO,以免污染空气
.
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是
在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
.




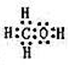
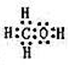
 H++HO2-
H++HO2- H++HO2-
H++HO2-