
 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;
 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;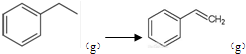 (g)+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol;
(g)+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1?K2;
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1?K2; ,故答案为:
,故答案为: ;
;| 0.624g |
| 312g/mol |


科目:高中化学 来源: 题型:
| A、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | ||||
B、实验室制取氯气:MnO2+4HCl(浓)
| ||||
| C、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | ||||
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表各组物质中,物质之间不可能实现如图所示转化的是)( )
下表各组物质中,物质之间不可能实现如图所示转化的是)( )| 选项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | NaOH | Na2CO3 | NaHCO3 | CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图的实验装置可用于实验室中制取乙炔.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑥ | B、②③⑤⑥⑦⑧ |
| C、②⑤⑦ | D、②⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com