
����Ŀ��ȫ��Һ����أ���Ʒ���أ����ĵ������Ի�ѧ�ܵķ�ʽ�洢�ڲ�ͬ��̬�����ӵ�������Һ�У��������ӽ���Ĥ��Ϊ�����ĸ�Ĥ���������Һƽ�������缫���沢�����绯ѧ��Ӧ������ܷ�ӦΪVO2++V3++H2O![]() V2++VO2++2H+����ͼ�Ƿ���ػ�������ԭ��ʾ��ͼ������˵���������
V2++VO2++2H+����ͼ�Ƿ���ػ�������ԭ��ʾ��ͼ������˵���������

A. �����ȫ�ŵ�����������ֱ�ΪVO2+��V3+������Һ
B. �ŵ�ʱ��������ӦʽΪV2+-e-=V3+
C. �������У��������Һ��pH����
D. ���ʱ��������ӦʽΪVO2++H2O-e-=VO2++2H+
���𰸡�C
���������ŵ�ķ�ӦΪ��V2++VO2++2H+ = VO2++V3++H2O����������ΪVO2+�õ���ת��ΪVO2+������ΪV2+ʧ����ת��ΪV3+����˵����ȫ�ŵ�����������ֱ�ΪVO2+��V3+������Һ��ѡ��A��ȷ���ŵ�ĸ�����V2+ʧ����ת��ΪV3+������ѡ��B��ȷ�����ĸ�����Ӧ����������ʵ���ǽ��ŵ�ĸ�����Ӧ�������Ϳ��ԣ���Ϊ��V3+ + e- = V2+������ע��������ӽ���Ĥ��Ϊ�����ĸ�Ĥ�����Է�Ӧ�������ӻ������ӽ���Ĥ�������ƶ������Ը����ĵ��Һ��pH���С��ѡ��C���ŵ���ܷ�Ӧ��ȥѡ��B�еĸ�����Ӧ���õ�������ӦΪ��VO2++2H++ e-=VO2++H2O�����䵹�������ǵ�⣨��磩��������VO2++H2O-e-=VO2++2H+��ѡ��D��ȷ��


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ag Mg��Al�Ͻ���ȫ�ܽ���C1mol/L��V1LHCl��Һ�У�����bmolH2������Ӧ�����Һ�м���C2mol/LV2L NaOH��Һ��ǡ��ʹ�����ﵽ���ֵ���ҳ�������Ϊdg�����й�ϵ����ȷ����
A. d=a+34b B. ![]()
C. ��������Ϊ![]() D. �������Ӧ��ʣ������Ϊ(C1V1-2b)mol
D. �������Ӧ��ʣ������Ϊ(C1V1-2b)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵����ȷ���ǣ� ��
A. 2.4g����þ���þ����ʱʧȥ�ĵ�����ĿΪ0.1NA
B. �����£�2g��������������ĿΪNA
C. ��25�棬![]() ʱ��11.2L����������ԭ����ĿΪNA
ʱ��11.2L����������ԭ����ĿΪNA
D. ��״����22.4L�����������ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�����������������
A. 0.5mol/LCuCl2��Һ�к��е�Cl-��ĿΪNA
B. 42gC2H4��C4H8�Ļ�����к�����ԭ����Ϊ6NA
C. ��״����,H2��CO�������4.48L������O2�г��ȼ������O2������Ϊ0.1NA
D. �ڷ�Ӧ4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O�У�����1molCl2ʱת�Ƶĵ�������Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ṹ��ʽ��ͼ������˵��������ǣ� �� ![]()
A.���л������ڱ�������
B.���л���������ֵ�Ȳ���ֱ��������ӳɵõ�
C.������2��3���������黥Ϊͬϵ��
D.������һ��ȡ�����ﹲ��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ��,����ú������������CO��H2����ȡ�״��������ķ�ӦΪCO(g)+2H2(g) ![]() CH3OH(g) ��H=-99kJ/mol��
CH3OH(g) ��H=-99kJ/mol��
��1�����ڸ÷�Ӧ������˵��,�������___________��
A.����CO������CH3OH���������ʱ��˵���÷�Ӧ�ﵽƽ��״̬
B.�����¶�,����Ӧ���ʼ�С���淴Ӧ��������
C.ʹ�ô������������CO��ת����
D.����ѹǿ���÷�Ӧ�Ļ�ѧƽ�ⳣ������
��2����ij�¶�ʱ����1.0mol CO ��2.0 mol H2����2 L�Ŀո�ƿ��,����������Ӧ,�ڵ�5 minʱ�ﵽ��ѧƽ��״̬����ʱ�״������ʵ�������Ϊ10%���״�Ũ�ȵı仯״����ͼ��ʾ:

�ٴӷ�Ӧ��ʼ��5 min ʱ�����ɼ״���ƽ������Ϊ________��
��5 min ʱ�ﵽƽ�⣬H2��ƽ��ת���ʦ�=_____%.��ѧƽ�ⳣ��K= _______��
��1min ʱ��v��(CH3OH)______ 4min ʱv��(CH3OH ) ������ڡ�С�ڡ����ڡ�����
��������ƿ����ͬ�ݻ��ľ��ȸ�ƿ���ظ�����ʵ�飬ƽ��ʱ�״������ʵ�������_____0.1(�>����<����=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�������������ȫȼ�գ��������������ǣ� ��
A.C6H6
B.C2H6
C.C3H6
D.CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ����( )
A.�����ڿ�����ȼ��
B.�������������������ֽ�
C.Ba(OH)2��8H2O��NH4Cl��Ӧ
D.п����ϡH2SO4��Ӧ��ȡH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������������ɫ��չ����̬������Ϊ�й�չʾ�������һ��������Ƭ����
��1�����Ṥҵ�ų���β������Ҫ��SO2���ж��ִ�����ʽ��
��д���ù�����ˮ����β�������ӷ���ʽ��___________________��
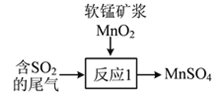
��β��Ҳ�������̿�MnO2�����գ�д����ͼ��ʾ����Ӧ1���Ļ�ѧ����ʽ��___________________��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��___________________��
��3��ij�������ۺϴ�����NH��ˮ��ҵ��������Ҫ��N2��Cl2��NO����������������̣�

������Ӧ1����������Cl2������Ӧ1���Ļ�ѧ����ʽΪ___________________��
�� ����Ӧ2�������ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com