
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
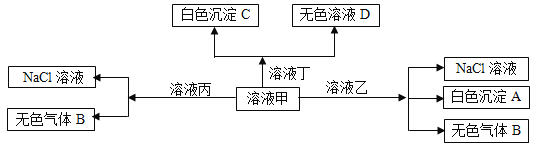
A.在甲中滴加丁可能发生反应:HCO3—+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I—、NO3—、SO42—
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
【答案】B
【解析】根据题意及物质间的关系可知:甲为NaHCO3;乙为AlCl3;丙为HCl;丁为Ba(OH)2;白色沉淀A是Al(OH)3 ;无色气体B是CO2;白色沉淀C是BaCO3;无色溶液D是Na2CO3 或NaOH,发生的反应为甲+乙:AlCl3+3NaHCO3=3NaCl+Al(OH)3↓+CO2↑;甲+丙HCl+NaHCO3=NaCl+H2O+CO2↑;甲+丁:Ba(OH)2+2NaHCO3= BaCO3↓+ Na2CO3+ 2H2O,据此解答。向碳酸氢钠溶液中滴加过量的Ba(OH)2溶液,根据“以少定多”的原则,离子方程式为HCO3—+ Ba2++OH—= BaCO3↓+ H2O,A项正确;丙为HCl,在酸性溶液在I-、NO3—因发生氧化还原反应而不能大量共存,B项错误;白色沉淀A为Al(OH)3 ,D可能为NaOH,Al(OH)3与强碱反应,C项正确;D.根据上述分析,甲为NaHCO3,乙为 AlCl3,D项正确;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
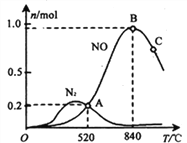
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
② 52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③ C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢
硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是
A.在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,![]() =0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq) ![]() SO42-(aq)+CaCO3(s)
SO42-(aq)+CaCO3(s)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应式为 3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是 ( )
A. 放电时负极的反应为:Zn - 2e-+2OH-![]() Zn(OH)2
Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 - 3e-+5OH-![]()
![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4
B.铜、二氧化硫
C.硫酸溶液、HCl
D.熔融的KNO3、酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的⑩种元素,用元素符号或化学式回答相关问题:

(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为______________。
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是_________。
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为_______________________。
⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为_______________________。
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为_____________。
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式________________________。
(6)写出下列物质的电子式:
①形成的单质______;
⑥与⑩形成的物质________;
用电子式表示④与⑦所组成物质的形成过程___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com