
【题目】下列装置或操作能达到实验目的的是

① ② ③ ④
A. 装置①可用于证明SO2与NaOH溶液发生了反应
B. 若装置②中X为CCl4,可用于吸收氨气或氯化氢
C. 装置③可用于实验室从食盐水中提取氯化钠
D. 装置④可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯
【答案】B
【解析】试题分析:A.二氧化硫易溶于水,锥形瓶中气压减小;
B.四氯化碳密度比水大,和水是互不相溶的,和氨气也不相溶;
C.蒸发操作利用蒸发皿,不能利用坩埚;
D.乙醇易挥发,能被高锰酸钾氧化.
解:A.二氧化硫易溶于水,锥形瓶中气压减小,无法证明SO2与NaOH溶液发生了反应,故A错误;
B.氨气或氯化氢是极易溶于水的气体,在处理时要防止倒吸,四氯化碳密度比水大,和水是互不相溶的,和氨气也不相溶,该装置可以防止倒吸,故B正确;
C.实验室中从食盐水中提取氯化钠,应利用蒸发,蒸发操作利用蒸发皿,不能利用坩埚,故C错误;
D.乙醇易挥发,能被高锰酸钾氧化,则该装置中生成的乙烯及挥发出的乙醇均使高锰酸钾溶液褪色,则不能证明溴乙烷与NaOH醇溶液共热生成乙烯,故D错误;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。
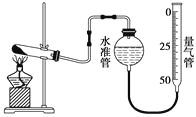
部分实验步骤:
①装好实验装置。
② 。
③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为m g。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热。
⑥测量收集到的气体体积。
⑦准确称量试管和残留物的质量为n g。
⑧测量实验室的温度。
回答下列问题。
(1)实验步骤的第②步是 ________________________________________________。
(2)测量收集到的气体体积,应注意的事项有:
①_____________________________________________________________________;
②_____________________________________________________________________;
③视线与凹液面最低处相平。
(3)如果实验中得到的氧气体积是p L,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为__________(含m、n、p)。
(4)假定其他操作均正确,未恢复至室温就读数会导致实验结果___________________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
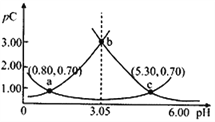
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出四种元素的元素符号。
A:________,B:________,C:________,D:________。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。
C:___________________________,D:_____________________________。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:____________。
(4)写出B元素单质和氢化物的电子式。单质:________,氢化物:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨有“光明使者”的美誉,在自然界中主要以钨(+6价)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe、Mn)WO4,钨酸(B)酸性很弱,难溶于水,黑钨矿传统冶炼工艺的第一阶段是碱熔法,第二阶段则是用还原剂还原出金属钨。化合物A、B、C含有同一元素。请回答下列问题:

(1)为提高水浸速率,采取的措施为___________________(写两种)。
(2)用还原剂还原出金属钨。
①碳和氢气均可还原化合物C得钨,用氢气比用碳更具有优点,其理由是___________。
②如果用金属铝与化合物C反应,还原出1mol钨至少需要铝的质量为___________。
(3)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
①一定温度下,向某恒容密闭容器中加入2molI2(g)和足量W(s)达平衡后,I2(g)的转化率为20%,则平衡时c[I2(g)]∶c[WI2(g)]=___________;相同条件下,若开始加入I2(g)的物质的量变为原来2倍,则下列数值是原来2倍的有___________(填标号)。
A.平衡常数 B.达到平衡的时间
C.I2(g)的物质的量浓度 D.平衡时WI2(g)的体积分数
②工业上利用上述反应原理提纯金属钨的示意图如右:

反应在真空石英管中进行,先在温度为T1端放入不纯W粉末和少量I2(g),一段时间后,在温度为T2的一端得到纯净的晶体,则温度T1___________T2(填:“>”、“<”或“=”)。
(4)写出黑钨矿中FeWO4在步骤Ⅰ中反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
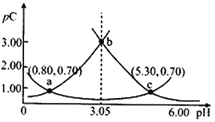
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.一小块钠投入水中:Na+2H2O===Na++2OH-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2===HCO![]()
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是重要的燃料和工业原料。目前,对CO的综合利用是科学家研究的热点。回答下列问题:
Ⅰ.工业制备CO的方法之一是甲烷氧化法。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
③2CO(g)+O2(g)=2CO2(g) △H=-330 kJ/mol
(1)反应2CH4(g)+O2(g)=2CO(g)+4H2(g),△H=_________kJ/mol。
Ⅱ.CO也是制备AlCl3的副产品
制备AlCl3的原理为:2Al2O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g) △H1
4AlCl3(g)+3O2(g) △H1
(2)已知该反应在较低温度下不能自发进行,则△H1_____0(填“>”“<”或“=”)
(3)制备AlCl3的实际生产过程中,常加入足量的碳粉,同时生成CO(g)。T1℃时,向恒容的密闭容器中加入5molAl2O3(s)、14molC(s)和6.4molCl2(g)发生反应。Cl2(g)的浓度变化如图(a)所示;图b为20min后改变容器中条件,平衡体系的反应速率(![]() )随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。
)随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。

①容器中发生反应的化学方程式为______________________________。
②0~15min内,用CO表示的该反应平均速率![]() =__________mol/(Lmin)
=__________mol/(Lmin)
③T1℃时,该反应的平衡常数K=______________(不需带单位)。
④40min时的平衡常数[K(40)]与15min时的平衡常数[K(15)]的大小关系:K(40)____K(15)(填“>”“<”或“=”)
⑤45min时,改变的条件为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况下,气体分子数相同的是( )
A.相同体积的CO和CO2
B.相同物质的量的H2O(g)和Cl2
C.在0℃时,1体积的O2和1体积的HCl
D.通常状况下71克Cl2和22.4LHCl气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com