
【题目】下列物质的水溶液因水解呈酸性的是( )
A.KCl
B.NaHSO4
C.NaHCO3
D.AlCl3
科目:高中化学 来源: 题型:
【题目】合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
(1)醋酸二胺合铜(I)可以除去原料气中的CO.Cu+基态核外电子排布式为 , 生成的CH3COO[Cu(NH3)3CO]中与Cu+形成配离子的配体为(填化学式).
(2)NH4NO3中N原子杂化轨道类型为 , 与NO3﹣互为等电子体的分子为(填化学式,举一例).
(3)1mol CO(NH2)2H2O2(过氧化尿素)中含有σ键的数目为 .
(4)钉(Ru)系催化剂是目前合成氨最先进的催化剂,一种钌的化合物晶胞结构如图所示,有关该晶体的说法正确的是(填字母).
a.晶胞中存在“RuO62﹣”正八面体结构
b.与每个Ba2+紧邻的O2﹣有12个
c.与每个O2﹣紧邻的Ru4+有6个
d.晶体的化学式为BaRuO3 . 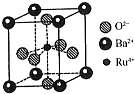
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )。
A. NaCl的摩尔质量是58.5g/mol B. 1mol NaOH的质量是40g
C. 1mol氮的质量是14g D. 1mol水的质量是18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA
B. 11.2 g Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
C. 标准状况下,22.4LH2O含有的分子数为NA
D. 2.3 g Na与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯,如图1所示实验装置: 
请回答下列问题:
(1)能完成本实验的装置是(从甲、乙、丙中选填)
(2)试管B中装入的液体为 . 试管B中发生反应的化学方程式为 .
(3)制取乙酸乙酯时加入试剂顺序为 , 发生反应的化学方程式为 .
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图2示的操作中,肯定需要的化学操作是(选填答案编号).
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须;某同学在进行分液操作时,若发现液体流不下来,应采取的措施是
(6)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)发生过程中的能量变化如图所示,下列说法不正确的是( ) 
A.该反应的△H<0
B.反应体系中加入催化剂,E1减小,E2增大
C.反应体系中加入催化剂,△H不变
D.反应达到平衡时,升高温度,A的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)从表中看出,升高温度,K值 , 则CO2的转化率 , 化学反应速率 . (以上均填“增大”“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为℃.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400 mL某浓度的NaOH溶液与5.6 L Cl2(标准状况)恰好完全反应,计算(写出必要的计算过程):
(1)生成的NaClO的物质的量。_____________
(2)该溶液中NaOH的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的性,填写了下表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO |
依照表中操作,该同学进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是 .
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是;
②装置乙的作用是;
③步骤ⅱ的目的是;
④该实验可得出的结论是 .
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com