
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T3 |
反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
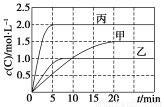
下列说法正确的是( )
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1 ℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
科目:高中化学 来源:2014年高考化学 题型十一 图像分析型专题练习卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
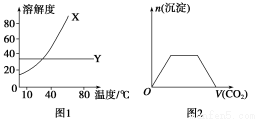
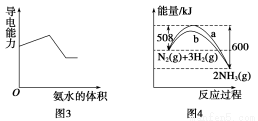
A.图1表明可用蒸馏法分离X、Y
B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2
C.图3表示向盐酸和醋酸混合溶液中滴入氨水
D.图4表示曲线b过程的热化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·
mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型八 能量变化型专题练习卷(解析版) 题型:选择题
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池。电池总反应为V2O4+xLi LixV2O4下列说法正确的是( )
LixV2O4下列说法正确的是( )
A.该电池充电时锂极与外电源的负极相连
B.电池在放电时,Li+向负极移动
C.该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D.若放电时转移0.2 mol电子,则用去的锂为1.4x g
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型二 化学用语型专题练习卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A.葡萄糖(C6H12O6)的结构简式:CH2O
B.Cl-的结构示意图: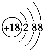
C.中子数为8的碳原子: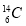
D.NaCl的电子式: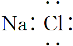
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型九 速率平衡型专题练习卷(解析版) 题型:选择题
在1 L密闭容器中发生反应:4NH3(g)+5O2(g)??4NO(g)+6H2O(g) ΔH=-Q kJ·mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
时间/浓度 | c(NH3) (mol·L-1) | c(O2) (mol·L-1) | c(NO) (mol·L-1) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
第10 min | 0.7 | 1.475 | 0.1 |
下列说法错误的是( )
A.反应在第2 min到第4 min时,O2的平均反应速率为0.187 5 mol·L-1·min-1
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min、第8 min时分别达到化学平衡,且平衡常数相同
D.在开始反应的前2 min内,该反应放出0.05Q kJ的热量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型三 NA应用型专题练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法一定正确的是( )
A.25 ℃,pH=13的NaOH溶液中含有OH-为0.1NA
B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1NA
C.2.24 L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型三 NA应用型专题练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法中正确的是( )
A.84 g NaHCO3晶体中含有NA个CO32-
B.9.2 g NO2和N2O4的混合气中含有的氮原子数为0.2NA
C.标准状况下,11.2 L臭氧中含NA个氧原子
D.78 g Na2O2与足量的CO2反应,电子转移个数为2NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型一 化学社会型专题练习卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.在有机化工中,氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:填空题
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
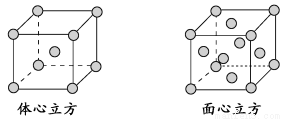
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com