
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
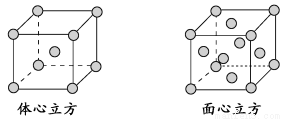
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(1)3d54s2 由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态需要的能量相对要少
(2)①具有孤对电子 ②sp1 N≡N
(3)分子晶体
(4)2∶1
【解析】(1)原子轨道处于全充满或半充满时能量较低,较稳定,故25Mn的价电子排布式为:3d54s2;Fe2+转化为Fe3+时,3d能级由3d6转变为较稳定的半充满状态3d5,而Mn2+转化为Mn3+时,3d能级却由较稳定的半充满状态3d5转变为3d4,所以气态Mn2+再失一个电子比Fe2+难。
(2)①形成配合物的中心原子要能提供空轨道,而配体中的分子或离子应能够提供孤对电子;②配体CN-中碳氮以碳氮叁键相连,为直线形结构,碳原子的杂化轨道类型为sp1;CN-为14电子的离子,故与CO、N2等互为等电子体,但符合题意的是N2(因题中限定为单质分子)。
(3)FeCl3的熔、沸点较低,可知FeCl3晶体为分子晶体。
(4)利用“均摊法”计算,面心立方晶胞中实际含有Fe原子的个数为8×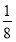 +6×
+6×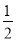 =4,体心立方晶胞中实际含有Fe原子的个数为8×
=4,体心立方晶胞中实际含有Fe原子的个数为8×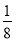 +1=2,故二者原
+1=2,故二者原
子个数之比为2∶1。


科目:高中化学 来源:2014年高考化学 题型九 速率平衡型专题练习卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T3 |
反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
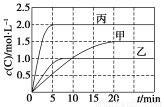
下列说法正确的是( )
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1 ℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学训练2.2.2分子空间构型分子性质练习卷(解析版) 题型:选择题
CO2、CH4、BF3都是非极性分子,HF、H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律正确的是( )。
A.所有原子在同一平面
B.分子中每个键的键长应相等
C.在ABn中A原子没有孤对电子
D.A的相对原子质量小于B
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学规范训练2.4分子间作用力物质性质练习卷(解析版) 题型:填空题
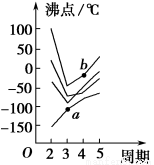
如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是____________,b点代表的是__________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学规范训练2.4分子间作用力物质性质练习卷(解析版) 题型:选择题
下列变化是在克服分子间作用力的情况下进行的是( )。
A.碘的升华 B.氨的液化
C.铝的熔化 D.食盐的溶解
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:选择题
干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为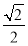 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。
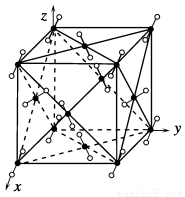
A.4个 B.8个 C.12个 D.6个
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:选择题
在纳米级的空间中,水的结冰温度是怎样的呢?为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是_________________________。
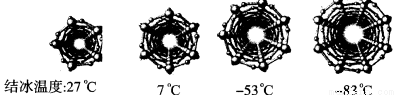
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:选择题
下列说法中正确的是( )。
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.NH3、H2O、CH4分子的几何构型均为三角锥形
C.NH3、H2O、CH4分子中的N、O、C原子均是采取sp2杂化的
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
某固体仅由一种元素组成,其密度为5.0 g·cm-3。用X射线研究该固体的结构时得知:在边长为10-7 cm的正方体中含有20个原子,则此元素的相对原子质量最接近于下列数据中的( )。
A.32 B.120 C.150 D.180
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com