
【题目】某固体仅由一种元素组成,其密度为5 g·cm3。用X射线研究该固体的结果表明:在棱长为1×10-7cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A. 32B. 65C. 140D. 150
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图如右图所示: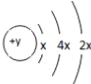 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为_______,其气态氢化物的化学式为________。
(2)D离子的离子结构示意图为__________________。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为_______________________(用元素符号比较)
(4)B的最高价氧化物的水化物与A的氢化物的水溶液反应的离子方程式式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2,并进行相关探究活动。
(已知:酸性强弱为H2SO3>H2CO3>HClO)
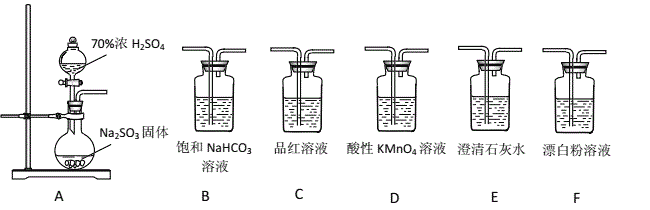
(1)装置A中反应的化学方程式为_________________________________________。
(2)甲同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到了C、D装置。
①C装置的作用是___________________________。
②通过___________________________________________________(填实验现象)即可证明亚硫酸酸性强于碳酸。
(3)乙同学认为利用上述装置也可以证明亚硫酸的酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) → C → F 。____________
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
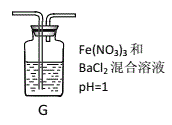
I.推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3-氧化;
原因二:SO2被Fe3+氧化;
原因三:_____________________________________________。
II.如果丙同学认为是因为“原因二”产生了白色沉淀。
①请你写出SO2被Fe3+氧化的离子方程式:_________________________________
②假如Fe3+恰好完全反应,请你设计实验证明其还原产物,并简要叙述实验过程、现象及结论。
___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事故或废弃药品的处理方法正确的是( )
A. 当有大量毒气泄漏时,人应沿顺风方向疏散
B. 实验室里电线失火,首先要断开电源
C. 当少量浓硫酸沾在皮肤上,应立即用氢氧化钠溶液冲洗
D. 酒精失火用水浇灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:M+N﹣→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81min,将温度提高到30℃时,完成反应的10%需要的时间为( )
A.9 min
B.27 min
C.13.5 min
D.3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将H2和I2各1mol的气态混合物充入1L的密闭容器中,发生反应:H2(g)+I2(g)2HI(g)△H<0;5min后达到平衡状态,测得c(H2)=0.9molL﹣1 , 则下列结论中,不能成立的是( )
A.平衡时H2、I2的转化率相等
B.从反应开始至平衡的过程中,v(HI)=0.04molL﹣1min﹣1
C.其他条件不变再向容器中充入少量H2 , I2的转化率提高
D.若将容器温度提高,其平衡常数K一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com