
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
B. 14g用于考古测年的14C原子中含中子数为8NA
C. 钠与氧气反应生成1molNa2O2时,转移电子数目为2NA
D. 28g乙烯中含有的共价键数目为6NA
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是
A. X的最高价氧化物的水化物一定为强酸 B. 气态氢化物的沸点:Y<M
C. 原子半径Z>M>X>Y D. Z是地壳中含量最多的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:_________,核外有_________种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
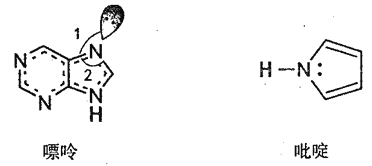
①嘌呤中所有元素的电负性由大到小的顺序__________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_____________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是______。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰___冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因______。
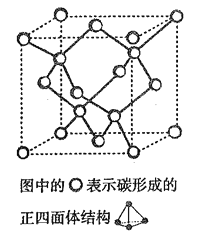
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是: 将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于生成物的总能量大于反应物的总能量的是( )
A.Ba(OH)2·8H2O 与 NH4Cl 的反应B.碳与二氧化碳的反应
C.铝片和稀盐酸反应D.甲烷在氧气中的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸. ①醋酸在水溶液中的电离方程式为 .
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是(填字母序号).
A.滴加少量浓盐酸 B.微热溶液
C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线. 
①滴定醋酸的曲线是(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是 .
③V1和V2的关系:V1V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 .
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验. 资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
操作步骤 | 现象 |
步骤1:向2mL 0.005molL﹣1 AgNO3溶液中加入2mL 0.005molL﹣1 KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴2molL﹣1 Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3molL﹣1 AgNO3溶液 | 现象a﹍﹍﹍,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3molL﹣1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式 .
②步骤3中现象a是 .
③用化学平衡原理解释步骤4的实验现象 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com