
【题目】
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
请完成以下实验设计表,并在实验目的一栏中填空:
实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究______________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _____ | 粗颗粒 | 2.00 | |
④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时B的转化率为_____________________。
(2)x的值为___________________。
(3)若温度不变,达平衡时容器内气体的压强是反应前的____________倍。
【答案】 1.00 35 探究固体物质的表面积(答接触面亦可) 20% x=4 1.2
【解析】试题分析:(Ⅰ) 根据实验①和②探究浓度对反应速率的影响,所以实验①和②中硝酸浓度不同;实验①和③探究温度对反应速率的影响,实验①和③的温度不同;实验①和④碳酸钙颗粒大小不同;
(Ⅱ)根据三段式解题法,求出混合气体各组分物质的量的变化量、平衡时各组分的物质的量.平衡时,生成的C的物质的量为0.2mol/(L﹒s)×5s×2L=2mol,
![]()
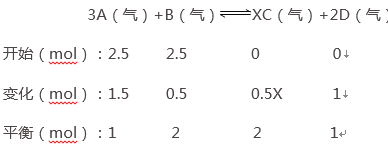
根据相关计算公式计算相关物理量。
解析:(Ⅰ) 根据实验①和②探究浓度对反应速率的影响,所以实验①和②中硝酸浓度不同,实验②中HNO3浓度为1.00mol/L;实验①和③探究温度对反应速率的影响,实验①和③的温度不同,实验③的温度选择35℃;实验①和④碳酸钙颗粒大小不同,实验①和④探究固体物质的表面积对反应速率的影响;
(Ⅱ)根据三段式法,平衡时,生成的C的物质的量为0.2mol/(L﹒s)×5s×2L=2mol,
![]()
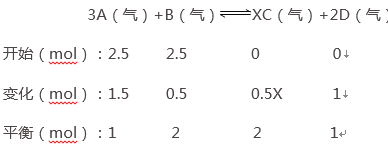
(1)达平衡时B的转化率为![]() 。
。
(2)![]() ,x=4。
,x=4。
(3)若温度不变,容器内气体的压强比等于物质的量比,![]()


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】某学生探究0.25moI/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g) ![]() CO(g) +H2(g)。不能确定上述可逆反应在一定条件下己达到化学平衡状态的是
CO(g) +H2(g)。不能确定上述可逆反应在一定条件下己达到化学平衡状态的是
A. 体系的压强不再发生变化 B. 1molH—H键断裂的同时断裂1 mol H—O键
C. v正(CO)=v逆(H2O) D. 生成n mol CO的同时消耗n mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 mL某气态混合烃在80 mL O2中充分燃烧,得到体积为65 mL的混合气体(气体体积均在相同条件20℃时测定),则该混合物不可能是 ( )
A. 丙烷和丙烯 B. 乙烷和丙烯 C. 丙烯和丁炔 D. 丁烯和丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

(1)氧化过程中发生反应的离子方程式是__________________,检验氧化生成的阳离子的试剂是________________。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。

①装置c的作用是____________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理__________,请说明理由__________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①SO2含量的表达式是_____________(用含m、V的代数式表示)。
②从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某化合物的结构如图甲,,图乙是计算机软件模拟出的该分子氢原子的核磁共振波谱图,单位是ppm;氢原子在分子中的化学环境(原子之间相互作用)不同,在核磁谱图中就处于不同的位置,化学环境相同的氢原子越多,吸收峰面积(或高度)越大(或高).其核磁共振波谱图如:

参考上述结构式,分析核磁谱图,回答下列问题:
(1)分子中共有________种化学环境不同的氢原子;谱线最高者表示有________个环境相同的氢原子,谱线最低者表示有________个环境相同的氢原子。
(2)结构式中的Et—表示烷烃基,从图谱中可以推断结构式中的这个烷烃基是________________(写出结构简式)
Ⅱ某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子。
(3)其分子式为_____________,结构简式为________________。
(4)其同分异构体中与其含有相同官能团的共有__________种(不含此有机物,填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:2A(g)![]() B(g)+C(g) ΔH
B(g)+C(g) ΔH
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
A(g) | B(g) | C(g) | ||
Ⅰ | 387 | 0. 20 | 0. 080 | 0. 080 |
Ⅱ | 387 | 0. 40 | ||
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
下列说法不正确的是
A. 该反应的正反应为ΔH<0
B. 207℃,K=4
C. 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同
D. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法一一鉴别出下列物质:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是( )
A.①②③④ B.③①②④
C.④①②③ D.③④②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤Al
A.②③ B.②③⑤ C.①②③⑤ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com