
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
【答案】B
【解析】
含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,结合反应判断实际参加反应的氧化剂与还原剂的物质的量之比。
①反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3为氧化剂,HCl为还原剂,实际参加反应的氧化剂与还原剂的物质的量之比1:5,错误;
②反应Fe2O3+2Al![]() Al2O3+2Fe中,Fe2O3为氧化剂,Al为还原剂,则氧化剂与还原剂的物质的量之比为1:2,正确;
Al2O3+2Fe中,Fe2O3为氧化剂,Al为还原剂,则氧化剂与还原剂的物质的量之比为1:2,正确;
③反应SiO2+3C![]() SiC(硅为+4价)+2CO↑中,碳既是氧化剂,也是还原剂,SiC是还原产物,CO是氧化产物,则氧化剂与还原剂的物质的量之比为1:2,正确;
SiC(硅为+4价)+2CO↑中,碳既是氧化剂,也是还原剂,SiC是还原产物,CO是氧化产物,则氧化剂与还原剂的物质的量之比为1:2,正确;
④反应3NO2+H2O=2HNO3+NO中,只有N元素的化合价变化,1molNO2作氧化剂与2molNO2作还原剂时满足电子守恒,则氧化剂与还原剂的物质的量之比为1:2,错误;
答案选B。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】化学科学的发展离不开物质结构的探索和研究。物质结构研究对于保护生态环境、实现社会的可持续发展有重要的意义。请回答下列问题:
(1)基态铜原子最外层电子所占用能级的电子云轮廓图形状为_____,基态硒原子的价电子排布图为____。
(2)次氯酸分子的VSEPR模型名称为_______,中心原子的杂化类型为_________。
(3)C、O、F三者的第一电离能由小到大的顺序为___________。
(4)CaO的熔点比BaO(填“高”或“低”),原因是______。
(5)H2SeO4的酸性比H2SeO3强,原因是_________。
(6)与CN-互为等电子体的离子有________(写出一种即可)。
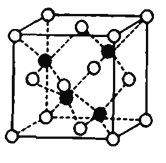
(7)Fe和S形成的某种晶胞如图所示:其中白球表示S,黑球表示Fe,则该物质的化学式为_______.该晶胞中硫原子的配位数为_______;假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为__________pm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空。
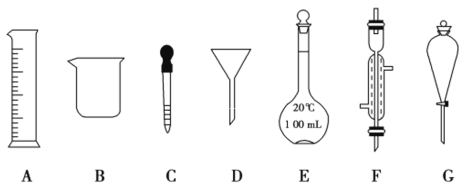
(1)写出仪器名称:F________,G________。
(2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(3)实验室配制100 mL 0.5 mol/L的盐酸。
①下列关于仪器E的使用方法中,正确的是________(填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到其中
②配制该溶液需用10 mol/L的浓盐酸________mL。
③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二价铬不稳定,极易被氧气氧化。醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:

制备过程中发生的化学反应或离子反应:
Zn+2HCl===ZnCl2+H2↑;2CrCl3+Zn===2CrCl2+ZnCl2;
2Cr2++4CH3COO-+2H2O===[Cr(CH3COO)2]2·2H2O↓。
请回答下列问题:
(1)仪器A的名称是______________,所盛装的试剂是______________。
(2)本实验中配制溶液所用的蒸馏水都需事先煮沸,原因是______________________________________________________________。
(3)仪器D的主要作用是______________。
(4)实验生成H2后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应________(填“打开”或“关闭”,后同)阀门1、________________阀门2。
(5)本实验中锌粒须过量,其原因是_______________________。
(6)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质6.34 g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 5.64 g,所得产品的产率为________。
(7)若使用该装置制备Fe(OH)2,且能较长时间看到Fe(OH)2 白色沉淀现象。则在仪器A、B、C中应装入的试剂依次为________、________、________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断 裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )
A.404B.260C.230D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,Y的最外层电子数是其所在周期数的2倍。Y在Z中充分燃烧能生成其最高价化合物YZ2。W+与Z2-具有相同的电子数。X在L中燃烧,产物XL溶于水得到一种强酸。请回答下列问题:
(1)X在周期表中的位置是_____。请写出实验室制备单质L的化学方程式______,尾气处理的离子方程式____________。
(2)由X分别与Y、Z形成的最简单化合物的稳定性关系为___________________。
(3)由X、Y、Z、W组成的一种盐,在面食中有大量使用,在其水溶液中滴入由X、Y、Z形成的厨房中常见的一种酸,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳架如图的烃(小黑球表示碳原子,黑球之间的连线表示共价键),下列说法正确的是( )

①a和e互为同分异构体 ②b是天然气的主要成分 ③d为平面型分子,属于芳香烃 ④b和c互为同系物 ⑤a、d、e的最简式相同
A. ①③⑤ B. ①②③ C. ②③④ D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com