
【题目】已知H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断 裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )
A.404B.260C.230D.200
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱。
(1)“550℃焙烧”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________。
(4)“净化除杂1”过程中,先在40℃-50℃加入H2O2,其作用是_______(离子方程式表示):再升温至80-85℃,加入Na2CO3溶液,调pH至4.5以达到净化除杂的目的。
(5)为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判断NH4HC2O4溶液呈________(填“酸性”、“碱性”或“中性”)。
②将草酸钴溶液用过量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液20.00mL,则草酸钴样品的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种白色固体:①氯化钠②氯化钡③无水硫酸铜④硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是( )
A.②③④①B.②④③①C.③①④②D.③②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG 表示溶液中的酸碱度,AG=lgc(H+)/c(OH-)。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
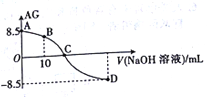
A. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
B. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20.00 mL
D. D点溶液中的pH=11.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科技、社会、生产、生活密切相关。下列有关说法错误的是
A.一些橡胶或塑料制品中要添加抑制剂是为了减缓橡胶塑料制品的老化速率
B.沼气属于生物质能,生物质能是可再生的能源
C.硅胶袋加入到袋装食品中起到脱氧剂的作用
D.面粉生产厂要求严禁烟火是因为面粉有机物颗粒极小、总表面积巨大容易被引燃爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,我国科研人员在探究如何降低大气中氮氧化物与碳氧化物的含量方面做出了巨大贡献,并取得了显著的成绩。
(1)下列关于氮氧化物与碳氧化物的说法中正确的是_____(填字母)。
A.CO2、NO2均属于酸性氧化物
B.NO、CO均不能用排空气法收集
C.除去NO中混有的NO2的方法是将混合气体通入足量氢氧化钠溶液中
D.除去CO中混有的CO2的方法是将混合气体通入足量氢氧化钠溶液中
(2)已知:N2(g)+O2(g)![]() 2NO(g)ΔH1=+180.5kJ/mol;
2NO(g)ΔH1=+180.5kJ/mol;
CO(g)![]() C(s)+1/2O2(g)ΔH2=+110.5kJ/mol;
C(s)+1/2O2(g)ΔH2=+110.5kJ/mol;
C(s)+O2(g)![]() CO2(g)ΔH3=-393.5kJ/mol。
CO2(g)ΔH3=-393.5kJ/mol。
则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH=__________
N2(g)+2CO2(g)ΔH=__________
(3)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。由此可知,提高尾气净化效率的最佳途径是_________;若要净化汽车尾气的同时提高该反应的反应速率和NO的转化率,且只改变一个反应条件,则应采取的措施是_________。
2CO2(g)+N2(g)可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。由此可知,提高尾气净化效率的最佳途径是_________;若要净化汽车尾气的同时提高该反应的反应速率和NO的转化率,且只改变一个反应条件,则应采取的措施是_________。
(4)某科研小组根据反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)来探究起始反应物的碳氨比[n(CO)/n(NO)]对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氯气的体积分数的变化如图所示.
N2(g)+2CO2(g)来探究起始反应物的碳氨比[n(CO)/n(NO)]对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氯气的体积分数的变化如图所示.

①根据图像推测曲线转化率1表示的是______ (填“CO”或“NO”)。
②A点时,n(CO)/n(NO)=_________,此时反应的平衡常数K= __________(请填写数值与单位)。
(5)煤炭在O2/CO2的气氛中燃烧会产生CO,有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。该提议_______(填“可行”或“不可行”), 理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止番茄在长途运输中发生腐烂,常常运输尚未完全成熟的果实,运到目的地后再用一种植物生长调节剂将其催熟。这种植物生长调节剂是下列物质中的
A. 乙烷 B. 乙烯 C. 乙炔 D. 乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com