
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱。
(1)“550℃焙烧”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________。
(4)“净化除杂1”过程中,先在40℃-50℃加入H2O2,其作用是_______(离子方程式表示):再升温至80-85℃,加入Na2CO3溶液,调pH至4.5以达到净化除杂的目的。
(5)为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判断NH4HC2O4溶液呈________(填“酸性”、“碱性”或“中性”)。
②将草酸钴溶液用过量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液20.00mL,则草酸钴样品的纯度为____%。
【答案】 除去碳和有机物 NaAlO2 、Na2ZnO2 2 Co3+ + SO32﹣+ H2O = 2 Co2+ + SO42﹣+ 2H+ 2 Fe2+ + 2 H+ + H2O2 = 2 Fe3+ + 2 H2O 酸性 73.5%
【解析】550℃焙烧含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)除去碳和有机物,加入氢氧化钠溶液,其中Al2O3溶解生成NaAlO2、Na2ZnO2,Co2O3、Fe2O3、CaO、MgO不溶,过滤,则浸出液的主要为NaAlO2、Na2ZnO2,向过滤得到的固体加入稀硫酸和亚硫酸钠,Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,可得CoCl2、FeCl2、MgCl2、CaCl2,在40~50℃加入H2O2,氧化Fe2+氧化为Fe3+,再升温至80~85℃,加入Na2CO3调pH至4.5,可得到Fe(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,滤液中主要含有CoCl2,加入草酸铵溶液得到草酸钴。
(1)“550℃焙烧”可以除去碳和有机物;故答案为:除去碳和有机物;
(2)ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱,加入氢氧化钠溶液,Al2O3溶解生成NaAlO2,ZnO生成Na2ZnO2,所以浸出液的主要成分为NaAlO2和Na2ZnO2,故答案为:NaAlO2、Na2ZnO2;
(3)“钴浸出”过程中Co3+转化为Co2+,则Na2SO3将Co3+还原为Co2+,自身被还原为硫酸钠,发生的反应为:2Co3++SO32-+H2O=2Co2++SO42-+2H+,故答案为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4)加入H2O2,氧化Fe2+氧化为Fe3+,反应为:2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(5)①NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。NH4HC2O4溶液中HC2O4-的水解平衡常数为Kh=![]() =
=![]() <Ka2;说明HC2O4-的水解程度小于HC2O4-电离程度,溶液显酸性,故答案为:酸性;
<Ka2;说明HC2O4-的水解程度小于HC2O4-电离程度,溶液显酸性,故答案为:酸性;
②称取1.00g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00mL,
根据5CoC2O4~5(NH4)2C2O4~2KMnO4,则样品中m(CoC2O4)=![]() ×20×10-3L×0.1mol/L×147g/mol=0.735g,故草酸钴样品的纯度为
×20×10-3L×0.1mol/L×147g/mol=0.735g,故草酸钴样品的纯度为![]() ×100%=73.5%,故答案为:73.5%。
×100%=73.5%,故答案为:73.5%。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图是某核苷酸与核苷酸长链的示意图,据图回答问题:

(1)已知图甲的分子结构式右上角的含氮碱基为腺嘌呤(A)。请观察后回答下列问题:
图甲所示的核苷酸的名称是_________。该核苷酸是构成______的原料。
(2)图乙为一条核苷酸长链的片段,据图回答:
①图中所示1、2、3的名称分别是___、___、_____。4、5的名称分别是__、__。
②此结构中与另一种核酸相比较,其特有的碱基中文名称是_________。
(3)将水稻根细胞中的遗传物质彻底水解后,可得到
A.一种五碳糖B.四种脱氧核糖核苷酸C.5种含氮碱基D.8种核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
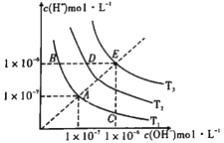
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe2O3、Al2O3两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
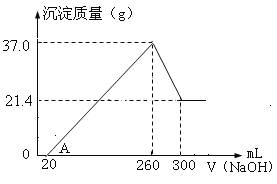
(1)原混合物中Fe2O3的质量是____________g。
(2)所用NaOH溶液物质的量浓度为___________。
(3)稀硫酸物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学的发展离不开物质结构的探索和研究。物质结构研究对于保护生态环境、实现社会的可持续发展有重要的意义。请回答下列问题:
(1)基态铜原子最外层电子所占用能级的电子云轮廓图形状为_____,基态硒原子的价电子排布图为____。
(2)次氯酸分子的VSEPR模型名称为_______,中心原子的杂化类型为_________。
(3)C、O、F三者的第一电离能由小到大的顺序为___________。
(4)CaO的熔点比BaO(填“高”或“低”),原因是______。
(5)H2SeO4的酸性比H2SeO3强,原因是_________。
(6)与CN-互为等电子体的离子有________(写出一种即可)。
(7)Fe和S形成的某种晶胞如图所示:其中白球表示S,黑球表示Fe,则该物质的化学式为_______.该晶胞中硫原子的配位数为_______;假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为__________pm.
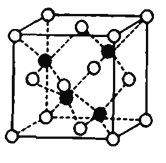
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是 ( )

① ② ③ ④
A. 用装置①精炼铜,a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②盐桥中KCl的Cl-移向乙烧杯
C. 装置③中钢闸门应与外接电源的负极相连获得保护
D. 装置④可以验证温度对化学平衡的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
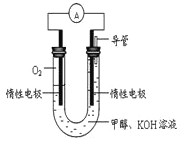
①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: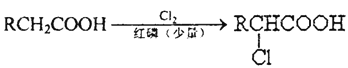
![]()
冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
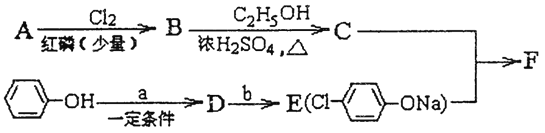
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为_________。
(2)写出符合A分子式的所有甲酸酯的结构简式:____________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:_______。
(4)C+E→F的反应类型为___________。
(5)写出A和F的结构简式:A______;F_______
(6)D的苯环上有两种氢,它所含官能团的名称为________;写出a、b所代表的试剂:a. _______b. _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断 裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )
A.404B.260C.230D.200
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com