解:(1)利用铜与浓硫酸反应的改进实验,实验目的是制备并验证二氧化硫的性质,所以需要生成二氧化硫气体进行性质验证,为了避免过多的污染气体生成又能满足实验要求,用抽动的铜丝控制反应的进行和停止,用于控制反应速率和生成用量;
故答案为:控制反应的开始和停止;
(2)生成的二氧化硫气体通过C装置时,由于吸收具有强氧化性,二氧化硫具有还原性,所以二氧化硫会被氧化为硫酸,硝酸被还原为无色的一氧化氮气体,遇到试管内空气中的氧气会反应生成红棕色二氧化氮气体,所以现象为:生成无色气体并变为红棕色;反应的化学方程式为:SO
2+HNO
3=H
2SO
4+NO 2NO+0
2=2NO
2故答案为:生成无色气体并变为红棕色 SO
2+HNO
3=H
2SO
4+NO 2NO+0
2=2NO
2(3)证明化学反应达到平衡的标志最根本的是正逆反应速率相同;
A、混合气体的密度等于气体质量除以总体积,在反应体系中都是气体,质量不变,反应在恒容容器中进行,体积不变,所以不能用来判断平衡的标志,故A错误;
B、c(SO
2):c(O
2):c(SO
3)=2:1:2,浓度之比在相同时间内等于速率之比,速率之比等于系数之比,只要正向进行就满足此关系,故不能用来判断平衡的标志,故B错误;
C、反应前后是 气体体积变化的反应,平衡移动,分子数变化,容器内气体分子总数不随时间变化,说明反应达到平衡,故C可以说明反应达到平衡;
D、相同时间内,消耗2n mol SO
2的同时消耗n mol O
2只能说明反应正向进行,不能作为平衡的标志,故D错误;
故答案为:C
(4)将0.23mol SO
2和0.11mol O
2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol
SO
3.依据化学平衡的三段式计算列式;
2SO
2(g)+O
2(g)

2SO
3(g)
起始量(mol) 0.23 0.11 0
变化量(mol) 0.12 0.06 0.12
平衡量(mol) 0.11 0.05 0.12
所以用SO
2浓度变化来表示反应速率=

=0.06mol/L?min
-1若此时保持温度不变,同时通入0.12mol SO
3和 0.15mol O
2,相当于各物质的量为
2SO
2(g)+O
2(g)

2SO
3(g)
0.11 0.05 0.12
0 0.15 0.12
0.11 0.2 0.24
温度不变,平衡常数不变,可以用此时的浓度商与平衡常数进行判断平衡移动的方向;
平衡常数K=

=

浓度商Qc=

=

=K,所以平衡不移动;
但若保持温度不变,只通入1.00mol O
2,平衡正向进行,增大了二氧化硫的转化率,本身转化率降低,则重新达到平衡时,二氧化硫的体积分数减小;
故答案为:0.06mol/L?min
-1;不移动;减小;减小;减小
分析:(1)依据铜与浓硫酸反应的实验,制备并验证二氧化硫的性质分析判断;
(2)依据吸收的强氧化性和二氧化硫的还原性进行分析判断,根据现象书写化学方程式;
(3)依据化学平衡状态的判断依据是正逆反应速率相等进行分析;
(4)根据化学平衡的三段式计算列式计算,结合化学反应速率的概念计算;依据影响平衡的因素的判断依据结合定量计算分析判断;
点评:本题考查了铜和浓硫酸的反应及产物的性质验证和现象解释,重点考查了化学平衡的 基本计算,化学反应速率的计算,平衡影响因素的分析判断,转化率的正确判断.


 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______. 2SO3(g)
2SO3(g) =0.06mol/L?min-1
=0.06mol/L?min-1 2SO3(g)
2SO3(g) =
=
 =
= =K,所以平衡不移动;
=K,所以平衡不移动;

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案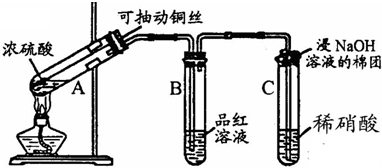
 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是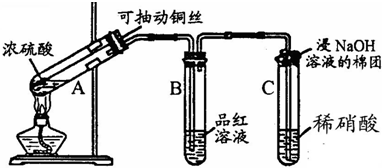


 2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。
2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。 
 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.