
【题目】A、B和C为短周期非金属元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等。回答下列问题:
(1)A、B和C分别为__________、____________、_____________(用元素名称表示)。
(2)由以上元素组成的化合物中,属于离子化合物的是___________,属于共价化合物的是_________。(各写一种即可)
(3)B的常见气态氢化物的电子式为_______________,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有____________(填化学键的种类),该离子氯化物的水溶液呈__________性,用离子方程式表示为_______________________。
【答案】(1)氧、氮、氢
(2)NH4NO3,HNO3
(3)![]() ;共价键,酸,NH4++H2O
;共价键,酸,NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
【解析】试题分析:A、B和C为短周期非金属元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,A为O元素;B是空气中含量最高的元素,B为N元素;C最外层电子数与电子层数相等,C为H元素。
(1)根据上述分析,A、B和C分别为氧、氮、氢,故答案为:氧、氮、氢;
(2)由以上元素组成的化合物中,属于离子化合物的是NH4NO3,属于共价化合物的是HNO3,故答案为:NH4NO3,HNO3;
(3)氨的电子式为![]() ,N的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子是NH4+,含有极性共价键,氯化铵属于强酸弱碱盐,水解显酸性,故答案为:
,N的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子是NH4+,含有极性共价键,氯化铵属于强酸弱碱盐,水解显酸性,故答案为:![]() ;共价键,酸,NH4++H2O
;共价键,酸,NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )

A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.若隔膜为阴离子交换膜,则OH-自左向右移动
C.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是 ( )

A.图1表示向100mL 1 mol·L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系
B.图2表示向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液,沉淀物质的量变化的关系
C.图3表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液叫做氨水。用离子方程式表示氨水成碱性的原因_________。
(2)实验室制备氨气,下列方法中可以选用的是 ____________。
①固态氯化铵加热分解 ②浓氨水中加入固体氢氧化钠
③加热浓氨水 ④固态氯化铵与氢氧化钙混合加热
(3)管道工人曾经用浓氨水检验氯气是否漏气。在有水蒸气存在的条件下能发生反应 2NH3+3Cl2=6HCl+N2。反应中如果有1.7克氨气被氧化,则被还原的氯气体积为__________L(标准状况下)。如果氯气管道漏气,用该方法检验时的现象是_______________________________。
(4)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。氨催化氧化的化学方程式为________________。将铂铑合金做成薄丝网的主要原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
(1)我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
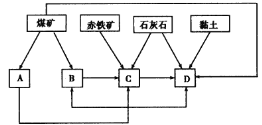
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定图中相应工厂的名称:A.________,B.________,C.________,D.________;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式:
__________________________________________________________;
。
(2)玻璃钢可由酚醛树脂和玻璃纤维制成。
①酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜________地加入甲醛,且反应釜应装有________装置。
②玻璃钢中玻璃纤维的作用是______。玻璃钢具有 等优异性能(写出两点即可)。
③下列处理废旧热固性酚醛塑料的做法合理的是________。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
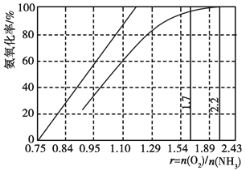
(3)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:

已知以下信息:
①![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________。

(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数目为_________。
(3)用NH3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。她成为首获科学类诺贝尔奖的中国人。青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯。下列有关说法正确的是

A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
根据①~⑿元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)

(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)画出原子结构示意图:⑾ 。
(5)用电子式表示⑦和⑩形成化合物的过程: 。
(6)⑦和⑧分别形成的气态氢化物的化学式是 、 。其中相对不稳定的是 。
(7)在③与④中,化学性质较活泼的是 ,(填元素符号)
在⑧与⑿中,化学性质较活泼的是 ,(填元素符号)如何证明(用离子方程式表示):
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com