
����Ŀ���±���Ԫ�����ڱ���һ���֡�
����������Ԫ�������ڱ��е�λ�ã��ش������й����⣺�����û�ѧ������д��

��1��д������Ԫ�ط��ţ��� ���� ��
��2������ЩԪ�ص�����������Ӧˮ�����У�������ǿ���� ��������ǿ���� �������Ե����������� �����û�ѧʽ��д��
��3������ЩԪ���е��ʵ���������ǿ���� ����ԭ����ǿ���� ����ѧ��������õ�Ԫ���� �����û�ѧʽ��д��
��4������ԭ�ӽṹʾ��ͼ���� ��
��5���õ���ʽ��ʾ�������γɻ�����Ĺ��̣� ��
��6���������ֱ��γɵ���̬�⻯��Ļ�ѧʽ�� �� ��������Բ��ȶ����� ��
��7�����������У���ѧ���ʽϻ��õ��� ������Ԫ�ط��ţ�
���������У���ѧ���ʽϻ��õ��� ������Ԫ�ط��ţ����֤���������ӷ���ʽ��ʾ����
��
���𰸡���1��N Si
��2��HClO4��KOH��Al��OH��3
��3����2��K��Ar
��4��![]()
��5��![]()
��6��H2S ��HCl��H2S
��7��Na��Cl�� Cl2+ 2Br-==Br2 + 2Cl-
���������������������Ԫ�����ڱ���Ԫ���٢ڢۢܢݢޢߢ���(11)(12)�ֱ���N��F��Na��Mg��Al��Si��S��Cl��Ar��K��Ca��Br����1��Ԫ�ط��ţ���N����Si��
��2���ǽ�����Խǿ����������Ӧˮ��������Խǿ����û�к����ᣬ����������ǿ����HClO4��������Խǿ����������Ӧˮ�������Խǿ����������ǿ����KOH�������Ե�����������Al(OH)3
��3���ǽ�����Խǿ������Խǿ�����ʵ���������ǿ���ǣ�2��������Խǿ��ԭ��Խǿ����ԭ����ǿ����K��ϡ�����廯ѧ��������ã�����õ�Ԫ����Ar��
��4��Caԭ�ӽṹʾ��ͼ��![]() ��
��
��5���õ���ʽ��ʾK��S�γ�K2S�Ĺ��̣�![]()
��6���ǽ�����Խǿ��̬�⻯��Խ�ȶ���S��Cl�ֱ��γɵ���̬�⻯��Ļ�ѧʽ��H2S��HCl��������Բ��ȶ�����H2S��
��7����Na��Mg�У���ѧ���ʽϻ��õ���Na
��Cl��Br�У���ѧ���ʽϻ��õ���Cl��Cl2+ 2Br-==Br2 + 2Cl-��֤����ѧ���ʽϻ��õ���Cl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��CΪ�����ڷǽ���Ԫ�أ�ԭ���������μ�С��A��������ϼ�Ϊ-2����������ۣ�B�ǿ����к�����ߵ�Ԫ�أ�C��������������Ӳ�����ȡ��ش��������⣺
��1��A��B��C�ֱ�Ϊ__________��____________��_____________(��Ԫ�����Ʊ�ʾ)��
��2��������Ԫ����ɵĻ������У��������ӻ��������___________�����ڹ��ۻ��������_________��(��дһ�ּ���)
��3��B�ij�����̬�⻯��ĵ���ʽΪ_______________��B�ij�����̬�⻯����������������Ӧ��ˮ���ﷴӦ����������Ӻ���____________(�ѧ��������)���������Ȼ����ˮ��Һ��__________�ԣ������ӷ���ʽ��ʾΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16�֣�����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1��2NO��g��+2CO��g��2CO2��g��+N2��g����H=��746.5KJ/mol ������Ϊʹ�ô�����
��֪��2C ��s��+O2��g��2CO��g����H=��221.0KJ/mol
C ��s��+O2��g��CO2��g����H=��393.5KJ/mol
��N2��g��+O2��g��=2NO��g����H= kJmol��1��
��2��T���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 | |||||||
C��NO��10��4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | |||||||
C��CO��10��3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | |||||||
��C2��������ֵΪ ������ĸ��ţ���
A��4.20 B��4.00 C��2.95 D��2.80
��3������ͬ���ʵ�����H2O��g����CO��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��H2O��g��+CO��g��CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
��a=2��b=1����c= ����ƽ��ʱʵ����ii��H2O��g����ʵ����iii��CO��ת���ʵĹ�ϵΪ��ii��H2O�� ��iii��CO�������������������=������
��4���������������Դ����CO�ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO��g��+4H2��g��CH3OCH3��g��+H2O��g������֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�![]() �ı仯������ͼ1��ʾ��
�ı仯������ͼ1��ʾ��
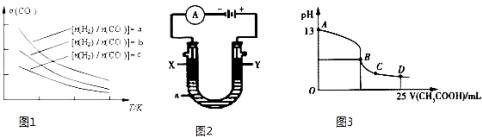
��a��b��c���Ӵ�С��˳������Ϊ ��
������ͼ������жϸ÷�ӦΪ���ȷ�Ӧ�������� ��
��5��CO�����Ĵ������ɲⶨ����β���Ƿ�����ŷű����÷����ǵĹ���ԭ��������ȼ�ϵ�أ����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�����ĵ缫��ӦʽΪ ��
�����������Ϊ��Դ��ͨ���������ӳ�ͼ2����X��YΪʯī��aΪ2L 0.1mol/L KCl��Һ���һ��ʱ���ȡ25mL �����������Һ���μ�0.4mol/L����õ�ͼ3���ߣ�������������ʧ����������ˮ����Һ����仯���Բ��ƣ�������ͼ�����㣬������������ ����һ����̼������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��V��U�Ƕ����ڵ�����Ԫ�أ�ԭ��������������X��Vͬ���壬����W�����γ�A2B��A2B2�ͻ����Z��W�ĵ��ʳ����¾�Ϊ��ɫ���壻Y��Uͬ������Yԭ�ӵ�L���������K���������2�����Իش��������⣺
��1��д��UԪ�������ڱ��е�λ�� ��V���ӽṹʾ��ͼΪ ��YW2�ĵ���ʽ ��
��2��Y��U�ļ��⻯����ȶ���������ǿ��˳���� ��
��3��V������������ˮ���ﲻ��ʹ�ò������Լ�ƿʢ�ŵ�ԭ���� �����û�ѧ����ʽ��ʾ��
��4����X��Z��ɵ�һ�ֻ����ﻯѧʽΪZX5�����ԭ�Ӿ��ﵽͬ����ϡ������ԭ�ӵ��ȶ��ṹ������������ (��������������������)�����
��5��X��Y��Z��W����Ԫ�أ���˳�����ԭ�Ӹ�����Ϊ5��1��1��3�Ļ�����û������ϡ��Һ����������������Һ�ڼ��������·�Ӧ�����ӷ���ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ�����ݻ�Ϊ2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ����ͼ�����ݷ�����
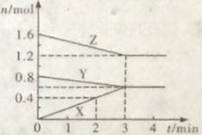
��1���÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��2����Ӧ��ʼ��2minĩ�� X�ķ�Ӧ����Ϊ ��
��3����Ҫ�ӿ�÷�Ӧ�Ļ�ѧ��Ӧ���ʿ��Բ�ȡ�Ĵ�ʩ�У���������Ũ�ȡ���ѹ�� ��ʹ���������ȡ�
��4����Ӧ�ﵽƽ��״̬����ʼʱ��Ϊ min,ƽ��ʱZ��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������Ҫ�ɷ�Ϊ��Ҫ�ɷ���Al2O3��������SiO2��Fe2O3����ȡ��������ұ��Al�IJ����������£�

��1������A�� ������B�� ��
��2������I��II��III�ķ�������������� ��
��3������IV������ʱʢ��ҩƷ������������ ��������Ӧ�Ļ�ѧ����ʽ�� ��
��4������III�з�����Ӧ��������C�����ӷ���ʽ��ʾΪ ��
��5��ȡ��ҺB100mL������1molL-1����200mLʱ���������ﵽ���������Ϊ11.7g������ҺB��c��Al��(OH)4��-��= ,c��Na+���� mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ�ΪFeTiO3(�ɱ�ʾΪFeO��TiO2)����������MgO��CaO��SiO2�����ʡ������������Ʊ�����ӵ�ص缫����(�����Li4Ti5O12�����������LiFePO4)�Ĺ�����������ͼ��ʾ��
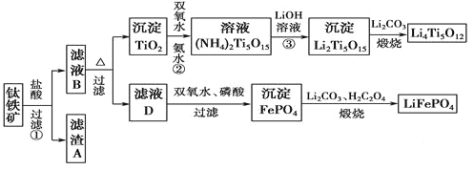
��֪��FeTiO3�����ᷴӦ�����ӷ���ʽΪ��FeTiO3+4H++4Cl��===Fe2++TiOCl42��+2H2O��
��1��������FeTiO3����Ԫ�صĻ��ϼ��� ��
��2������A�ijɷ��� ��
��3����ҺB��TiOCl42��ת������TiO2�����ӷ���ʽΪ ��
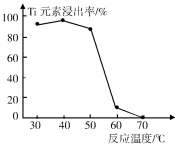
��4����Ӧ���й���TiO2ת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶ȵĹ�ϵ��ͼ��ʾ����Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½���ԭ���� ��
��5��д������ҺD����FePO4�����ӷ���ʽ ��
��6������ҺD�Ʊ�LiFePO4�Ĺ����У�����17%˫��ˮ��H2C2O4���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��3�����ʽṹ������]
��1�������й�������������˵����ȷ����
A����λ����ǿ���д���С�������е��������ȶ����еĺܲ��ȶ�
B��ˮ���ȵ��ܸߵ��¶ȶ����Էֽ�����Ϊˮ���Ӽ�������
C���ڻ����ڹ⻬��ǽ������������Ϊ�ڻ��ŵ�ϸë���������ķ��Ӳ������Ӽ�������
D����Ϊ�����칹���ķ��Ӿ�����ȫ��ͬ����ɺ�ԭ�����У�������������ҩ��ʱ������������칹��
��2���ж������ĸ�ģ�ʹ�����������п�Ķѻ���ʽ ��

��3����������δ�ɶԵ���������P��Ԫ�ص�Ԫ�ط����� ���������ռ��
��ԭ�ӹ����
��4��̼������ϩ��������ӵ�ص��µ��Һ����Ҫ���Ӽ�����ṹ��ͼ��̼ԭ�ӵ��ӻ���ʽ�� ���������Ҽ���м�֮��Ϊ ��
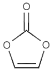
��5���Ƚ�NH2����NH3�ļ�����HNH�Ĵ�С��NH2�� NH3���������=���������������ü۲���ӶԻ������ͣ� ��
��6��SO32������ԭ�ӵļ۲���ӶԻ���ģ���� ��д��һ����SO32����Ϊ�ȵ�����ķ��� ��
��7��SiC��������ʯ�������ƣ��辧���߳�Ϊa cm��̼ԭ��ֱ��Ϊb cm����ԭ��ֱ��Ϊc cm����þ����Ŀռ�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3���ʽṹ�����ʡ�
ԭ�������������������Ԫ��A��B��C��D���δ��ڵ�һ���������ڣ���Ȼ���д��ڶ���A�Ļ����Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��B��C���γ����������η��ӣ�D�Ļ�̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��ش��������⣺
��1��������Ԫ���е縺������Ԫ�أ����̬ԭ�ӵļ۵����Ų�ͼΪ ��
��2��C�������������Ԫ�طֱ���A�γɵĻ�����е��ɸߵ��͵�˳���� ���ѧʽ����������˵ݱ���ɵ�ԭ���� ��
��3��BԪ�ؿ��γɶ��ֵ��ʣ�һ�־���ṹ��ͼһ��ʾ����ԭ�ӵ��ӻ�����Ϊ ����һ�ֵľ�����ͼ����ʾ�������ʽ��ʾ�þ����Ŀռ������� ��
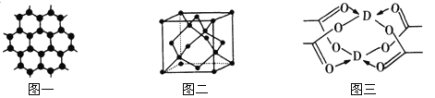
��4��DԪ���γɵĵ��ʣ��侧����Dԭ�ӵ���λ��Ϊ ��D�Ĵ����ξ���ֲ��ṹ��ͼ�����þ����к��еĻ�ѧ���� (��ѡ�����)��
�ټ��Լ� �ڷǼ��Լ� ����λ�� �ܽ�����
��5��DԪ���γɵĵ��ʣ��Ȳ����ڰ�ˮҲ������˫��ˮ�����������ߵĻ����Һ��д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com