
����Ŀ������ѧ����ѡ��3���ʽṹ�����ʡ�
ԭ�������������������Ԫ��A��B��C��D���δ��ڵ�һ���������ڣ���Ȼ���д��ڶ���A�Ļ����Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��B��C���γ����������η��ӣ�D�Ļ�̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��ش��������⣺
��1��������Ԫ���е縺������Ԫ�أ����̬ԭ�ӵļ۵����Ų�ͼΪ ��
��2��C�������������Ԫ�طֱ���A�γɵĻ�����е��ɸߵ��͵�˳���� ���ѧʽ����������˵ݱ���ɵ�ԭ���� ��
��3��BԪ�ؿ��γɶ��ֵ��ʣ�һ�־���ṹ��ͼһ��ʾ����ԭ�ӵ��ӻ�����Ϊ ����һ�ֵľ�����ͼ����ʾ�������ʽ��ʾ�þ����Ŀռ������� ��
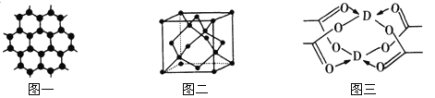
��4��DԪ���γɵĵ��ʣ��侧����Dԭ�ӵ���λ��Ϊ ��D�Ĵ����ξ���ֲ��ṹ��ͼ�����þ����к��еĻ�ѧ���� (��ѡ�����)��
�ټ��Լ� �ڷǼ��Լ� ����λ�� �ܽ�����
��5��DԪ���γɵĵ��ʣ��Ȳ����ڰ�ˮҲ������˫��ˮ�����������ߵĻ����Һ��д���÷�Ӧ�����ӷ���ʽ ��
���𰸡���1��![]()
��2��HF��HI��HBr��HCl HF����֮���γ������ʹ��е�ϸߣ�HCl��HBr��HI���Ӽ��Է��Ӽ���������ϣ���Է�������Խ���»���Խ�е�Խ�ߡ�
��3��sp2 ![]()
��4��12 �� �٢ڢ�
��5��Cu+4NH3��H2O+ H2O2��[Cu(NH3)4]2++2OH-+4 H2O
��������
���������ԭ�������������������Ԫ��A��B��C��D�ֱ��ڵ�һ���������ڣ���Ȼ���д��ڶ���A�Ļ������AΪ��Ԫ�أ�Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬����������6�����ӣ�BΪ̼Ԫ�أ�D�Ļ�̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ�Dԭ����Χ�����Ų�Ϊ3d104s1����DΪͭԪ�أ����ԭ��������֪��Cֻ�ܴ��ڵ������ڣ�B��C���γ����������ͷ��ӣ���BΪ��Ԫ�ء�
��1������Ԫ���е縺��������Cl�����̬ԭ�ӵļ۵�����Ϊ7����̬ԭ�ӵļ۵����Ų�ͼΪ![]()
��2��HF����֮���γ������ʹ��е�ϸߣ�HCl��HBr��HI���Ӽ��Է��Ӽ���������ϣ���Է�������Խ���»���Խ�е�Խ�ߣ����е��ɸߵ��͵�˳����HF��HI��HBr��HCl��
��3��ͼһΪƽ��ṹ�������״�ṹ��̼̼������Ϊ120�㣬ÿ��̼ԭ�Ӷ������3��̼ԭ�ӣ�̼ԭ�Ӳ�ȡsp2�ӻ������ݾ�����ʾ��ͼ��֪��������ÿ��Cԭ������Χ4��Cԭ���γ���������ṹ����̼ԭ�Ӱ뾶Ϊr�������ı߳�Ϊa��![]() =2r��r=
=2r��r=![]() ��������̼ԭ�ӵĸ���Ϊ8��1/8+6��1/2+4=8����̼ԭ�ӵ����Ϊ
��������̼ԭ�ӵĸ���Ϊ8��1/8+6��1/2+4=8����̼ԭ�ӵ����Ϊ![]() r3��8�����������Ϊa3����þ����Ŀռ�������
r3��8�����������Ϊa3����þ����Ŀռ�������![]() ��
��![]() ��3��a3��100%=
��3��a3��100%=![]() ��
��
��4������CuΪ�����������ܶѻ��������侧����Cuԭ�ӵ���λ��Ϊ12�����ͼ������ͭ����ľֲ��ṹ��ȷ���侧���к��м��Լ����Ǽ��Լ�����λ������ѡ�٢ڢۡ�
��5��Cu2���пչ����NH3���й¶Ե��ӣ�Cu2������NH3����λ����ϳɻ����ͭ���ʼȲ����ڰ�ˮҲ������˫��ˮ�����������ߵĻ����Һ����÷�Ӧ�����ӷ���ʽΪCu+4NH3��H2O+ H2O2��[Cu(NH3)4]2++2OH-+4 H2O��


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡�
����������Ԫ�������ڱ��е�λ�ã��ش������й����⣺�����û�ѧ������д��

��1��д������Ԫ�ط��ţ��� ���� ��
��2������ЩԪ�ص�����������Ӧˮ�����У�������ǿ���� ��������ǿ���� �������Ե����������� �����û�ѧʽ��д��
��3������ЩԪ���е��ʵ���������ǿ���� ����ԭ����ǿ���� ����ѧ��������õ�Ԫ���� �����û�ѧʽ��д��
��4������ԭ�ӽṹʾ��ͼ���� ��
��5���õ���ʽ��ʾ�������γɻ�����Ĺ��̣� ��
��6���������ֱ��γɵ���̬�⻯��Ļ�ѧʽ�� �� ��������Բ��ȶ����� ��
��7�����������У���ѧ���ʽϻ��õ��� ������Ԫ�ط��ţ�
���������У���ѧ���ʽϻ��õ��� ������Ԫ�ط��ţ����֤���������ӷ���ʽ��ʾ����
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5���л���ѧ������������³����![]() ����һ�־ֲ����������������ýϿ졢��ǿ�����Խϵͣ���ϳ�·�����£�
����һ�־ֲ����������������ýϿ졢��ǿ�����Խϵͣ���ϳ�·�����£�
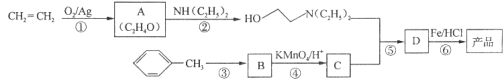
��֪����![]()
��![]()
��
��ش��������⣺
��1��A�ĺ˴Ź�������ֻ��һ���壬��A�Ľṹ��ʽΪ____________________��
��2��C�Ľṹ��ʽΪ__________��C�к��еĺ��������ŵ�����Ϊ__________��
��3���ϳ�·��������������Ӧ����_________������ţ�����Ӧ���ķ�Ӧ����Ϊ_______________��
��4����Ӧ���Ļ�ѧ��Ӧ����ʽΪ______________________________________________��
��5��B��ij��ͬϵ��E����Է���������B��28��������NO2�뱽��ֱ����������E�Ľṹ��ʽΪ____________________����дһ�֣���
��6����������������E��ͬ���칹�����Ŀ��__________�֡�
���ṹ�к���һ������NH2����һ������COOH�� ��������������������ͬ��ȡ����
��7���������ᣨ![]() �����������İ�����֮һ��д���䷢�����۷�Ӧ�Ļ�ѧ����ʽ____________________________________________________________��
�����������İ�����֮һ��д���䷢�����۷�Ӧ�Ļ�ѧ����ʽ____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2��ѧ�뼼�������Ṥҵ�ڹ�����ռ�м�����Ҫ�ĵ�λ��
��1����ҵ������ʱ�������������Ҫ�ɷ�ΪFeS2��������Ԫ�صĻ�����Ϊ ��
��2�������������������ǻ��ʹ�ҵ������������ij��������� (��дһ��)��
��3�����������У����ݻ�ѧƽ��ԭ����ȷ�����������ʩ�� (��д���)��
A����ʯ�������¯֮ǰ�ȷ��� B��ʹ��V2O5������
C��ת������ʹ�����˵��¶� D���������¯����Ҫ�й����Ŀ���
E���������ڳ�ѹ�½��� F������������98.3%��Ũ��������SO3
��4�������Ṥҵ�У�ͨ�����з�Ӧʹ��������ת��Ϊ��������
2SO2(g)��O2(g) ![]() 2SO3(g)�� ��H����98.3 kJ��mol��1
2SO3(g)�� ��H����98.3 kJ��mol��1
��ʵ�ʹ�ҵ�����У������á���ת����������������һ��ת�����ɵ�SO2�����δת����SO2���ж���ת������������SO2��ת���ʾ�Ϊ95%��������SO2��ת����Ϊ ��
��5������Ĺ�ҵ�Ʒ������漰������Ҫ�Ļ�ѧ��Ӧ����Ӧ���豸(����¯��ת������������))��
�������豸�ֱ�ʹ��Ӧ��֮����������������ˡ�����������������������з�Ӧ��֮�������������ġ�
____________________________________________________________________��
�ڹ�ҵ�����г��ð����ᷨ����β�������Դﵽ������Ⱦ���������õ�Ŀ�ġ��û�ѧ����ʽ��ʾ�䷴Ӧԭ����(ֻд��2������ʽ����)
______________________________________________________________________
_____________________________________________________________________��
��6��ʵ���ҿ��������᳧¯��(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ��������̷�(FeSO47H2O)�������Ļ�ѧʽΪ[Fe2(OH)n(SO4)3��0.5n]m���Ʊ�������ͼ��ʾ������˵����ȷ���� ��

A��¯����FeS������������ķ�Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+�T4Fe3++4S��+6H2O
B������M�ijɷ���SO2��ͨ��˫��ˮ�õ����ᣬ��ѭ��ʹ��
C������ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���ٽ���ҺY�����ᾧ���ɵõ��̷�
D����ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NOx��CO�ȴ�����Ⱦ����Ĵ��������õķ���������Ҫ���壬��ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�� ���ü������ԭNOx��
CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H1=��574kJmol��1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H2=��1160kJmol��1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���������·�Ӧ��CO(g)+H2O(g) ![]() H2(g)+CO2(g)��500��ʱ��ƽ�ⳣ��Ϊ9�����ڸ��¶��½��У�����ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020 mol��L��1����CO��ƽ��ת����Ϊ�� ��
H2(g)+CO2(g)��500��ʱ��ƽ�ⳣ��Ϊ9�����ڸ��¶��½��У�����ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020 mol��L��1����CO��ƽ��ת����Ϊ�� ��
��3�� �û���V2O5��������������NO��ԭ��N2��һ�ַ�Ӧ������ͼ1��ʾ��
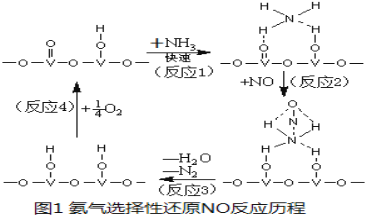
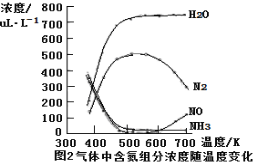
��д���ܷ�Ӧ��ѧ����ʽ ��
�ڲ�ø÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵΪ��lgK=5.08+217.5/T���÷�Ӧ�� ��Ӧ������ȡ����ȡ�����
�۸÷�Ӧ�ĺ�������������¶ȱ仯��ͼ2��ʾ�����¶ȴﵽ700Kʱ����������Ӧ�Ļ�ѧ����ʽ ��
��4����ͼ����ʳ��ˮ�����Һ��������ѵ���һ��ԭ��ͼ��NO��������������������������ΪNO3����β��������������Һ���պ��������������ͼ�������ܶȺ���ҺpH������������Ӱ�졣
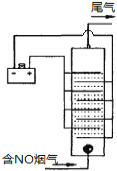
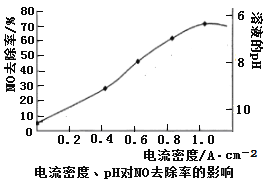
��NO��������������������������ΪNO3����Ӧ�����ӷ���ʽ ��
����Һ��pH��NOȥ����Ӱ���ԭ���� ��
�����������10cm2��ʵ��������NO 1.5%������Ϊ0.070L��s��1���������������ɱ�״̬�������������������屻�������������ڳ���Ϊ96500 C��mol��1����õ����ܶ�Ϊ1.0 A��cm��2����ʽ����ʵ����NO��ȥ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
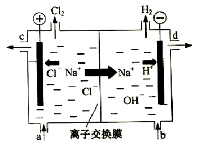
���������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ��
��2�����ӽ���Ĥ������Ϊ�� ��
��
��3�����Ʊ���ʳ��ˮ��ͼ�� λ�ò��䣬����������Һ��ͼ�� λ����������ѡ�a������b������c����d����
��4��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۻ�ѧ����ѡ��3�����ʽṹ�����ʣ�̫���ܵ�ذ���ϳ��������⣬����ͭ�������ء����Ȼ�ѧ���ʡ�
��1����̬��ԭ�ӵļ۵����Ų�ͼ�� ��
��2��������ͬΪVIA��Ԫ�أ��������ڵ�Ԫ��������壬������Ԫ�ص��ڶ���������С�����˳��Ϊ ������I2X��ʾ��
��3����̬SeO3���ӵ��ӻ�����Ϊ ����SeO3��Ϊ�ȵ������һ��������Ϊ ���ѧʽ����
��4������CuSO4��5H2O��д��[Cu(H2O) 4]SO4 ��H2O����ṹʾ��ͼ���£�
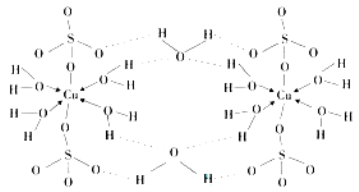
�����к��е����Ӽ��������� ������ţ���
A�����Ӽ� B�����Լ� C�������� D����λ�� E����� F���Ǽ��Լ�
��5��������ͭ��Һ�м������KCN�����������K 2[Cu(CN)4]������������� ���壬��֪CN-��N2Ϊ�ȵ����壬ָ��1molCN-��![]() ������ĿΪ ��
������ĿΪ ��
��6��һ��ͭ��Ͻ�����������������ܶѻ��ṹ���ھ����н�ԭ��λ�ڶ��㣬ͭԭ��λ�����ģ���úϽ���ͭԭ�ӣ�Cu�����ԭ�ӣ�Au��������Ϊ �����þ���ľ����ⳤΪa nm����úϽ��ܶ�Ϊ g/cm3�����г�����ʽ����Ҫ��������������ӵ�������ֵΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ�Һϳ���һϵ�о��ж��ػ�ѧ���Ե�����������(AlH3)n����������ԭ������֪�������������Ļ�ѧʽΪAl2H6�������۵�Ϊ150��������״̬���ܵ��磬ȼ��ʱ�ų�������������Al2H6�����ģ����ͼ��ʾ������˵���������
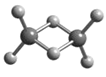
A. Al2H6��AlΪ��3�ۣ�HΪ��1��
B. Al2H6�к������Ӽ��ͼ��Թ��ۼ�
C. Al2H6�ڹ�̬ʱ���γɵľ����Ƿ��Ӿ���
D. Al2H6�ڿ�������ȫȼ�գ�����Ϊ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�á���ش�����������
��1��һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��1/4CaSO4��s��+CO��g��![]() 1/4CaS��s��+CO2��g�� ��H = - 47.3kJmol-1
1/4CaS��s��+CO2��g�� ��H = - 47.3kJmol-1
��ӦCaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H= kJmol-1��
CaS(s)+3CO2(g) ��H= kJmol-1��
ƽ�ⳣ��K������ʽΪ ��
��2��ͼ1Ϊ���ܱ�������H2S����ֽ�����H2��S2(g)��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��
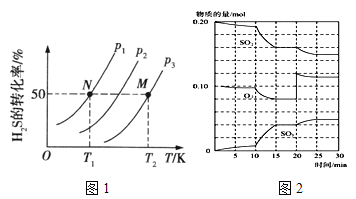
ͼ1��ѹǿp1��p2��p3�Ĵ�С˳��Ϊ �������� ���÷�Ӧƽ�ⳣ���Ĵ�С��ϵΪK(T1) K(T2) (�>������<����=��)�������� ��
��3����һ�������£���������������������·�Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g) ��H��0
2SO3(g) ��H��0
��600��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ2����Ӧ����ƽ��״̬��ʱ����� ��
����ͼ2�жϣ���Ӧ������20minʱ�����߷����仯��ԭ���� �������ֱ����10min��15min�����߱仯��ԭ������� ����д��ţ���
A�����˴��� B����С�������
C�������¶� D������SO3�����ʵ���
��4�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c(Na��)= ���ú�����Ũ�ȵĴ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com