
【题目】【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。

A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
【答案】(1)-1;(2)硫酸铵(或硫酸钾或过磷酸钙等) ;(3)D;(4)99.75%;
(5)①SO3从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流;
②SO2+NH3+H2O===NH4HSO3;2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑;[或SO2+2NH3+H2O===(NH4)2SO3;(NH4)2SO3+H2SO4===(NH4)2SO4+H2O+SO2↑(6)AB;
【解析】
试题分析:
(1)FeS2中铁元素是+2价,则硫元素为-1价;
(2)用硫酸制造的常见化肥有硫酸铵、硫酸氢铵、硫酸锌、硫酸钾等;
(3)硫酸生产中,第二步:SO3的制取反应原理为:2SO2+O2![]() 2SO3,该反应为可逆反应,根据化学平衡原理为了提高SO2的转化率,通常采用增大O2浓度的方法来达到使SO2尽可能多的转化为SO3的目的。A.矿石加入沸腾炉之前先粉碎,目的是为了增大黄铁矿与空气的接触面,加快4FeS2+11O2
2SO3,该反应为可逆反应,根据化学平衡原理为了提高SO2的转化率,通常采用增大O2浓度的方法来达到使SO2尽可能多的转化为SO3的目的。A.矿石加入沸腾炉之前先粉碎,目的是为了增大黄铁矿与空气的接触面,加快4FeS2+11O2![]() 2Fe2O3+8SO2 反应速率,而不是从2SO2+O2
2Fe2O3+8SO2 反应速率,而不是从2SO2+O2![]() 2SO3 反应中化学平衡角度考虑,故A不正确;B.使用V2O5作催化剂,催化2SO2+O2
2SO3 反应中化学平衡角度考虑,故A不正确;B.使用V2O5作催化剂,催化2SO2+O2![]() 2SO3 反应,只能加快该反应的速率,不能使平衡移动,故B不正确;C.接触室中催化转化器使用适宜的温度,目的是使催化剂活性最强,使反应速率最快,而实际上升高温度,会促使2SO2+O2
2SO3 反应,只能加快该反应的速率,不能使平衡移动,故B不正确;C.接触室中催化转化器使用适宜的温度,目的是使催化剂活性最强,使反应速率最快,而实际上升高温度,会促使2SO2+O2![]() 2SO3 平衡向吸热方向移动,即逆向移动,不利于提高SO2的转化率,故C不正确;D.从沸腾炉中出来的气体成分为SO2、O2、N2,经过净化后,进入接触室,炉气中要有过量的空气,即增大O2浓度,会促使2SO2+O2
2SO3 平衡向吸热方向移动,即逆向移动,不利于提高SO2的转化率,故C不正确;D.从沸腾炉中出来的气体成分为SO2、O2、N2,经过净化后,进入接触室,炉气中要有过量的空气,即增大O2浓度,会促使2SO2+O2![]() 2SO3 平衡正向移动,有利于提高SO2的转化率,故D正确;E.接触室中:2SO2+O2
2SO3 平衡正向移动,有利于提高SO2的转化率,故D正确;E.接触室中:2SO2+O2![]() 2SO3,增大压强促使平衡正向移动(即气体总体积减小的方向),减小压强促使平衡逆向移动(即气体总体积增大的方向).在常压下,不利于平衡正向移动,不利于提高SO2的转化率.对于该化学平衡,压强的增大,促使平衡正向移动,效果并不明显,所以工业上直接采用常压条件,而不采用高压条件,故E不正确;F.吸收塔中用98.3%的浓硫酸吸收SO3,主要目的是防止产生酸雾,阻碍SO3的吸收,与化学平衡移动原理无关,故F不正确;
2SO3,增大压强促使平衡正向移动(即气体总体积减小的方向),减小压强促使平衡逆向移动(即气体总体积增大的方向).在常压下,不利于平衡正向移动,不利于提高SO2的转化率.对于该化学平衡,压强的增大,促使平衡正向移动,效果并不明显,所以工业上直接采用常压条件,而不采用高压条件,故E不正确;F.吸收塔中用98.3%的浓硫酸吸收SO3,主要目的是防止产生酸雾,阻碍SO3的吸收,与化学平衡移动原理无关,故F不正确;
(4)设二氧化硫的初始浓度为a,则第一次转化掉的二氧化硫浓度为a×95%,剩余的二氧化硫浓度为a×(1-95%),进入第二次转化,则第二次转化掉的二氧化硫浓度为a×(1-95%)×95%,根据公式:转化率═转化浓度/初始浓度×100%,最终SO2的转化率═[a×95%+a×(1-95%)×95%]/a×100%═99.75%;
(5)①从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动,从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换,故答案为:从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动;从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换;②工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,先用氨水吸收时,发生反应:SO2+2NH3H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的;
(6)分析流程可知炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,溶液X为含有Fe3+离子的溶液,调节溶液PH得到溶液Z加热得到聚铁,溶液X中加入铁反应生成硫酸亚铁溶液Y,蒸发结晶得到硫酸亚铁晶体。A、炉渣中FeS与硫酸和氧气反应生成硫单质硫酸铁和水,反应的离子方程式为4FeS+3O2+12H+═4Fe3++4S↓+6H2O,故A正确;B、炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,固体W灼烧得到气体为二氧化硫,故B正确;C、溶液X中加入过量铁粉,铁和硫酸铁溶液反应生成硫酸亚铁,通过蒸发浓缩,冷却结晶,过滤析出得到绿矾,符合晶体析出步骤,故C错误;D、用pH试纸测定方法为:将试纸放在表面皿上,用洁净的玻璃棒蘸取待测液,点在试纸的中央,然后与标准比色卡对比.氢氧化铁的含量比硫酸亚铁高,若溶液Z的pH偏小,则聚铁中生成的氢氧根的含量减少,使铁的含量减少,故D错误;选AB。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、V、U是短周期的主族元素,原子序数依次增大。X与V同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y与U同主族且Y原子的L层电子数是K层电子数的2倍。试回答下列问题:
(1)写出U元素在周期表中的位置 ;V离子结构示意图为 ;YW2的电子式 。
(2)Y、U的简单氢化物的稳定性由弱到强的顺序是 。
(3)V的最高价氧化物的水化物不能使用玻璃塞试剂瓶盛放的原因是 。(用化学方程式表示)
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于 (填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
(1)下列有关微粒间作用力的说法正确的是
A.配位键的强度有大有小,所以有的配合物很稳定,有的很不稳定
B.水加热到很高的温度都难以分解是因为水分子间存在氢键
C.壁虎能在光滑的墙壁上行走是因为壁虎脚底的细毛与物体表面的分子产生分子间作用力
D.互为手性异构本的分子具有完全相同的组成和原子排列,所以生产手性药物时无需分离手性异构体
(2)判断下列哪个模型代表金属晶体锌的堆积方式 。

(3)第四周期未成对电子数最多的P区元素的元素符号是 ,核外电子占据
个原子轨道。
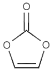
(4)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图。碳原子的杂化方式有 ,分子中σ键与π键之比为 。
(5)比较NH2-和NH3的键角∠HNH的大小:NH2- NH3(填“﹥”“=”“﹤”),请用价层电子对互斥规解释: 。
(6)SO32-中硫原子的价层电子对互斥模型是 ;写出一种与SO32-互为等电子体的分子 。
(7)SiC晶胞与金刚石晶胞相似,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
已知碳元素能形成多种金属碳化物,如碳化钙,俗称为电石。
(1)电石(CaC2)是用CaO与焦炭在电炉中加强热反应生成的,写出此反应的化学方程式 ,CaC2中含有化学键的类型为 ,C22-与N2互为等电子体,C22-的电子式可表示为 ,其中σ键和π键数目之比为 。
(2)已知MgO、CaO的熔点分别为2852℃、2614℃,分析熔点差异的原因是 。
(3)苯丙氨酸是一种重要的氨基酸,其结构如图所示,分子中第一电离能最大的原子价电子排布式是 ,其中碳原子的杂化方式有 。
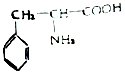
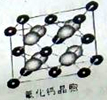
(4)已知CaF2晶体(如图,Ca2+处于面心)的密度为ρg/cm3,NA为阿伏加德常数,相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量(M)可以表示为 g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现通过以下步骤由![]() 制备
制备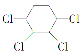
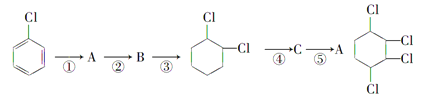
(1)写出A、B的结构简式:A:______________ B:______________。
(2)从左到右依次填写每步反应所属的反应类型(a.取代反应,b.加成反应,c.消去反应,只填字母代号): 。
(3)写出④的反应方程式:
(4)写出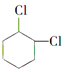 的含有六元碳环的同分异构体:
的含有六元碳环的同分异构体:
(5)写出该制备方法的合成路线图,有机合成路线图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。
【I】日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献。请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是___________。
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
(2)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
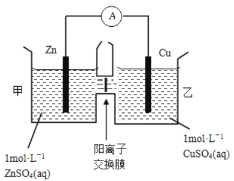
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
【II】自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(3)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应的可用离子方程式表示为___________。
(4)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,己知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3物质结构与性质】
原子序数依次增大的四种元素A、B、C、D依次处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,用最简式表示该晶胞的空间利用率 。
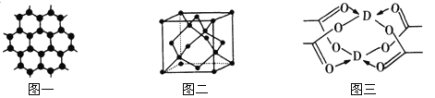
(4)D元素形成的单质,其晶胞内D原子的配位数为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)D元素形成的单质,既不溶于氨水也不溶于双氧水,但溶于两者的混合溶液。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
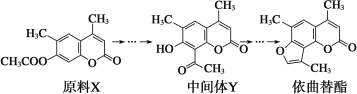
下列说法不正确的是( )
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去、氧化、还原反应
D.1 mol依曲替酯能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
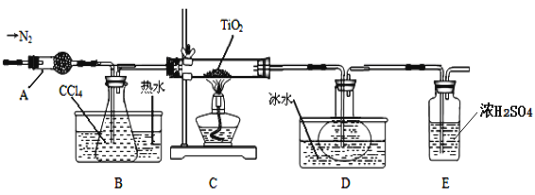
【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL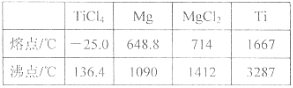 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com