
【题目】已知X、Y、Z、W、V、U是短周期的主族元素,原子序数依次增大。X与V同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y与U同主族且Y原子的L层电子数是K层电子数的2倍。试回答下列问题:
(1)写出U元素在周期表中的位置 ;V离子结构示意图为 ;YW2的电子式 。
(2)Y、U的简单氢化物的稳定性由弱到强的顺序是 。
(3)V的最高价氧化物的水化物不能使用玻璃塞试剂瓶盛放的原因是 。(用化学方程式表示)
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于 (填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为: 。
【答案】(1)第3周期第ⅥA族; ;
;![]() 。
。
(2)SiH4<CH4。(3)SiO2+2NaOH=Na2SiO3+H2O(4)离子。
(5)NH4++HCO3-+2OH-![]() NH3↑+ CO32-+2H2O。
NH3↑+ CO32-+2H2O。
【解析】试题分析:已知X、Y、Z、W、V、U是短周期的主族元素,原子序数依次增大。X与V同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体,所以W时O,X与V是H和Na;Y与U同主族且Y原子的L层电子数是K层电子数的2倍,因此Y是C,U是Si,Z是N。
(1)S元素在周期表中的位置是第3周期第ⅥA族;钠离子结构示意图为 ;CO2的电子式为
;CO2的电子式为![]() 。
。
(2)同主族自上而下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则Y、U的简单氢化物的稳定性由弱到强的顺序是SiH4<CH4。
(3)二氧化硅能与氢氧化钠溶液反应生成粘性较强的硅酸钠而使玻璃塞和瓶口粘合在一起,不易打开,反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,因此该物质是氢化铵,是由铵跟和H—组成的离子化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物是硝酸铵,其稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为NH4++HCO3-+2OH-![]() NH3↑+ CO32-+2H2O。
NH3↑+ CO32-+2H2O。


科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液叫做氨水。用离子方程式表示氨水成碱性的原因_________。
(2)实验室制备氨气,下列方法中可以选用的是 ____________。
①固态氯化铵加热分解 ②浓氨水中加入固体氢氧化钠
③加热浓氨水 ④固态氯化铵与氢氧化钙混合加热
(3)管道工人曾经用浓氨水检验氯气是否漏气。在有水蒸气存在的条件下能发生反应 2NH3+3Cl2=6HCl+N2。反应中如果有1.7克氨气被氧化,则被还原的氯气体积为__________L(标准状况下)。如果氯气管道漏气,用该方法检验时的现象是_______________________________。
(4)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。氨催化氧化的化学方程式为________________。将铂铑合金做成薄丝网的主要原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。她成为首获科学类诺贝尔奖的中国人。青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯。下列有关说法正确的是

A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的外围电子排布式为 ;

(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)Co的一种氧化物的晶胞如下图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
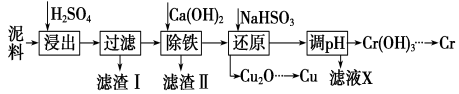
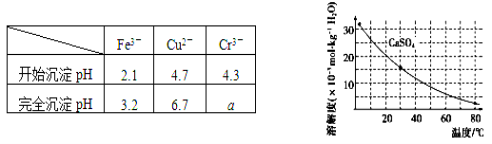
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__________________。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约________,检验Fe3+已经除尽的操作是_________________;
②将浊液加热到80℃,______________________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是_______。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥______。[已知:Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):

(1)若D为白色胶状难溶物,且与A摩尔质量相等,反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸(无氧酸),则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
根据①~⑿元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)

(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)画出原子结构示意图:⑾ 。
(5)用电子式表示⑦和⑩形成化合物的过程: 。
(6)⑦和⑧分别形成的气态氢化物的化学式是 、 。其中相对不稳定的是 。
(7)在③与④中,化学性质较活泼的是 ,(填元素符号)
在⑧与⑿中,化学性质较活泼的是 ,(填元素符号)如何证明(用离子方程式表示):
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。某化学兴趣小组同学展开对亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用下图所示装置进行实验。

(1)装置②中产生ClO2气体的化学方程式为 。
(2)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。过滤用到的玻璃仪器有 。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作是: 。
(4)反应结束后,关闭K2、打开K1,装置①的作用是 ;如果撤去D中的冷水浴,可能导致产品中混有的杂质是 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。

A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com