
【题目】[化学——选修3:物质结构与性质]太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的价电子排布图: 。
(2)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的第二电离能由小到大的顺序为 。(用I2X表示)
(3)气态SeO3分子的杂化类型为 ,与SeO3互为等电子体的一种阴离子为 (填化学式)。
(4)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4 ·H2O,其结构示意图如下:
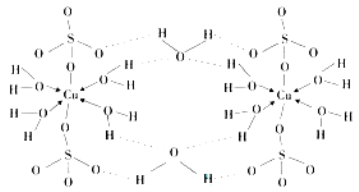
胆矾中含有的粒子间作用力是 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物K 2[Cu(CN)4],该配合物属于 晶体,已知CN-与N2为等电子体,指出1molCN-中![]() 键的数目为 。
键的数目为 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为 ;若该晶体的晶胞棱长为a nm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏加德罗常数的值为NA)
【答案】(1) 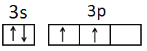 (2分) (2)I2As<I2 Br<I2 Se(2分)
(2分) (2)I2As<I2 Br<I2 Se(2分)
(3)平面三角形 (2分) CO32-或NO3-(2分) (4)ABDE (5)离子晶体,2NA
(6)3:1 (2分) 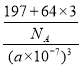 (2分)
(2分)
【解析】
试题分析:(1)硅是14号元素,根据原子核外电子排布规律可知其电子排布式为:1s22s22p63s23p2,因此基态硅原子的价电子排布图为 ;
;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电离能呈增大趋势,但Se元素失去有关电子后4p能级是半满稳定状态,能量较低,第二电离能高于同周期相邻元素,故第二电离能由小到大的顺序为I2As<I2 Br<I2 Se;
(3)气态SeO3分子中中心原子的价层电子对数为![]() =3,无孤电子对,因此分子构型为平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;
=3,无孤电子对,因此分子构型为平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;
(4)铜离子和硫酸根离子之间存在离子键,硫原子和氧原子间存在极性共价键,铜原子和氧原子间存在配位键,氧原子和氢原子间存在氢键,答案选ABDE;
(5)在硫酸铜溶液中加入过量KCN,生成配合物K 2[Cu(CN)4],该配合物是由离子构成,因此属于离子胶体,已知CN-与N2为等电子体,说明在CN-中C、N之间存在一个三键,其中有两个π键、一个δ键,所以1molCN-中π键的数目为2NA;
(6)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-7cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
=3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-7cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=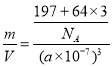 gcm-3。
gcm-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:
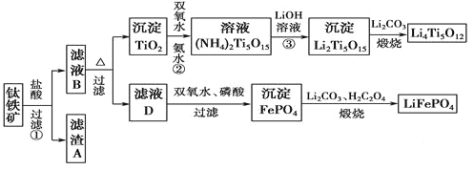
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式为 。
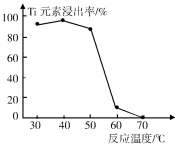
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现通过以下步骤由![]() 制备
制备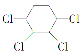
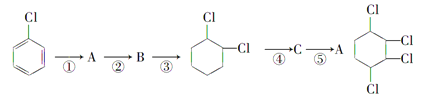
(1)写出A、B的结构简式:A:______________ B:______________。
(2)从左到右依次填写每步反应所属的反应类型(a.取代反应,b.加成反应,c.消去反应,只填字母代号): 。
(3)写出④的反应方程式:
(4)写出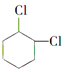 的含有六元碳环的同分异构体:
的含有六元碳环的同分异构体:
(5)写出该制备方法的合成路线图,有机合成路线图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3物质结构与性质】
原子序数依次增大的四种元素A、B、C、D依次处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,用最简式表示该晶胞的空间利用率 。
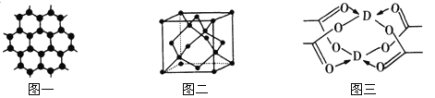
(4)D元素形成的单质,其晶胞内D原子的配位数为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)D元素形成的单质,既不溶于氨水也不溶于双氧水,但溶于两者的混合溶液。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修2:化学与技术】
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料采用硝酸铵氧化分解技术生产CuC1的工艺过程如下:
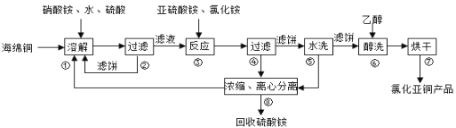
回答下列问题:
(1)步骤①中得到的氧化产物是___________,溶解温度应控制在60-70℃,原因是___________;
(2)写出步骤③中主要反应的离子方程式_________________;
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是__________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_________________;
(5)步骤②、④、⑤、⑧都要进行固液分离.工业上常用的固液分离设备有_______(填字母)
A、分馏塔 B、离心机 C、反应釜 D、框式压滤机
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
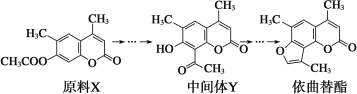
下列说法不正确的是( )
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去、氧化、还原反应
D.1 mol依曲替酯能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是内层电子数的3倍;D与G处在同一族;F是地壳中含量最高的金属元素。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)B、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于 (填晶体类型)。
(4)CA3分子的电子式为 。
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
(6)由A、D、G中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4。则甲分子的中心原子采取 杂化;1 mol乙分子含有 molσ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为:
Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g) △H=35.9 kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g) △H=14.9kJ/mol
(1)反应2H2(g)+ O2(g)=2H2O(l)的△H= mol·L-1。
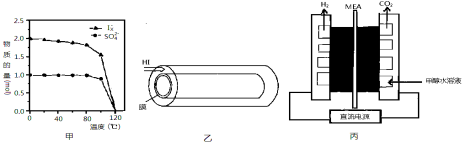
(2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1mol SO2和3mol I2,在不同温度下恰好完全反应生成的n(SO42-)和n(Ix-)的变化见图甲。
①Ix-中x= 。②温度达到120℃时,该反应不发生的原因是 。
(3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度 ___ (填“增大”、“减小”或“不变”),在该装置中为了进一步增大达平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 。
(4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。
①写出阳极电极的反应式: 。
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
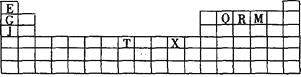

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com