
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
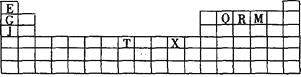

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
【答案】(1)1s22s22p63s23p63d5d区
(2)N>O>C C、N、O原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大,但O价电子排布为2s22p4,而N的价电子排布为2s22p3,p电子排布处于半充满状态,更稳定,电离能大
(3)BD
(4)高 Li+半径比Na+小,Li2O晶格能大
(5)Li 1分
【解析】试题分析:(1)T为Fe,原子序数为26,Fe3+的核外电子为23,根据核外电子排布规律可知其电子排布为[Ar]3d5或1s22s22p63s23p63d5。区的名称来自于按照构造原理最后填入电子的轨道名称,因此铁位于d区。
(2)C、N、O原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大,但O价电子排布为2s22p4,而N的价电子排布为2s22p3,p电子排布处于半充满状态,更稳定,电离能大,所以第一电离能为N>O>C。
(3)A.J为Na,X为Cu,Na的活泼性强与水反应,所以在溶液中不能置换出Cu,A错误;B.J2M2为Na2O2,化学反应中化学键断裂,将J2M2溶于水生成氢氧化钠和氧气,要破坏离子键和共价键,B正确;C.氨气中存在氢键,所以氨气的沸点高,C错误;D.一个C2H4分子中含有4个C-H键,1个碳碳双键,双键是由1个σ键和一个π键构成的,因此含有五个σ键和一个π键,D正确,答案选BD。
(4)G为Li,J为Na,离子半径越小,金属键越强,Li离子半径小,所以熔点高。
(5)G与R单质直接化合生成一种离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子水为6×![]() =2,Li3N中离子个数为3:1,所以层与层之间还原子为Li。
=2,Li3N中离子个数为3:1,所以层与层之间还原子为Li。


科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的价电子排布图: 。
(2)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的第二电离能由小到大的顺序为 。(用I2X表示)
(3)气态SeO3分子的杂化类型为 ,与SeO3互为等电子体的一种阴离子为 (填化学式)。
(4)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4 ·H2O,其结构示意图如下:
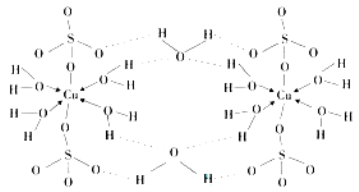
胆矾中含有的粒子间作用力是 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物K 2[Cu(CN)4],该配合物属于 晶体,已知CN-与N2为等电子体,指出1molCN-中![]() 键的数目为 。
键的数目为 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为 ;若该晶体的晶胞棱长为a nm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。某研究性学习小组探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 时,催化剂对汽车尾气的催化效果最好。(填a、b、c、d)

(2)工业上也常用NaOH溶液吸收法处理NOx ,已知:NO + NO2 + 2NaOH= 2NaNO2 + H2O(I)
2NO2 + 2NaOH =NaNO2 + NaNO3 + H2O(II)
现有2 240 mL(标准状况)NO 和NO2的混合气体溶于200 mL NaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是 。
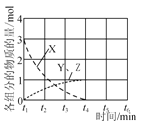
(3)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
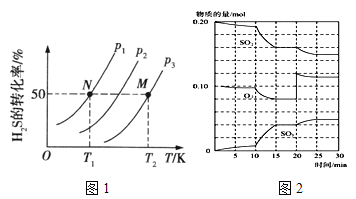
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:
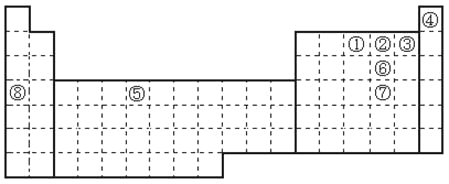
(1)写出①~⑧号元素中第一电离能最大的元素符号___________。
(2)写出②⑥⑦三个元素气态氢化学的沸点顺序___________。(填分子式顺序)
(3)请画出[Cu(NH3)4]2+离子结构示意图___________。
(4)请画出⑤的外围电子排布图___________。
(5)SeO3的空间构型为___________。
(6)SeO32-离子的VSEPR构型为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】含氮化合物在生活中应用十分广泛。神州飞船外壳使用了氮化硅新型陶瓷结构材料,该材料硬度大、耐磨损。可用石英与焦炭在1400~1450℃的氮气气氛下合成氮化硅,同时生成一种与氮气结构相似的气态分子。
(1)写出上述反应的化学方程式____________________________________。反应原料中涉及的元素电负性由大到小的排列顺序为________________________________。
(2)基态氮原子中的原子轨道形状有 _______________种。
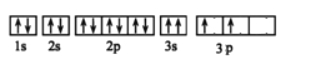
(3)某同学画出了硅原子基态的核外电子排布图如下图,该电子排布违背了 原理。
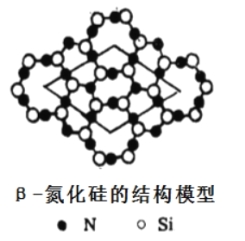
(4)氮化硅有多种型体,其中β-氮化硅层状结构模型如图,以图中所示的平行四边形为基本重复单元无限伸展,则该基本单元中含氮原子______个,硅原子______个。
(5)含氮的有机化合物氨基乙酸H2NCH2COOH中的碳 原子杂化方式有____________,σ与π键的个数比为_______________。
(6)氨分子是一种常见的配体。Cu2+离子在水溶液中以 [Cu (H2O)4]2+形式存在,向含Cu 2+离子的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+离子,其原因是 。某配合物的化学式为 CoCl3·4NH3, 内界为正八面体构型配离子。0.1 mol该化合物溶于水中,加入过量 AgNO3,有14.35g 白色沉淀生成。则它的中心离子价电子排布式为____________,內界可能的结构有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡原理是中学化学学习的重要内容,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气(主要成分CO、H2)制备甲醇。
(1)己知:CO、H2、CH3OH、的燃烧热(△H)分别为-283.0kJ/mol、-241.8kJ/mol、-192.2 kJ/mol,请写出合成气制备甲醇的热化学方程式 。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
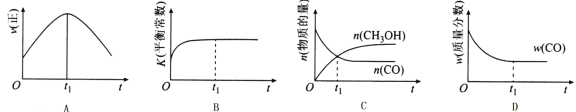
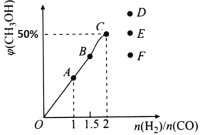
(3)在T1℃时,在体积为5 L的恒容容器中充入3 mol的合成气,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。H2和CO按2:1投入时经过5 min达到平衡,则5 min内用H2表示的反应速率为v(H2)=_______。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
(4)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:________________________。
(5)水的自偶电离可表示为H2O+H2O![]() H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
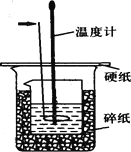
(1)箭头所指仪器的名称是 。作用是 。
(2)实验所用的NaOH溶液体积与盐酸相同,但浓度却比盐酸大的原因是 。
(3)用相同浓度和体积的醋酸代替HCl溶液进行上述实验,放出的热量会 。(填“偏大”“偏小”或“无影响”)。测得的△H会 (填“偏大”“偏小”或“无影响”)。
(4)上图所示实验装置存在着一处错误,这处错误是 。
(5)实验测得中和热△H =" -" 57.3 kJ·mol–1若忽略能量的损失,请你计算出实验前后温度的差值△t (保留一位小数,水的比热容c=4.18J/(g·℃)两种溶液的密度近似取1g/ml )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用以下装置制取并探究氨气的性质。
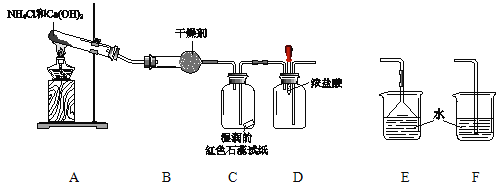
(1)A中反应的化学方程式是 。
(2)B中的干燥剂是 。
(3)C中的现象是 。
(4)实验进行一段时间后,挤压D装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是 。
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是 (填“E”或“F”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com