
����Ŀ����ѧƽ��ԭ������ѧ��ѧѧϰ����Ҫ���ݣ���ش��������⣺
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ�Ͽ��úϳ�������Ҫ�ɷ�CO��H2���Ʊ��״���
��1����֪��CO��H2��CH3OH����ȼ��������H���ֱ�Ϊ-283.0kJ/mol��-241.8kJ/mol��-192.2 kJ/mol����д���ϳ����Ʊ��״����Ȼ�ѧ����ʽ ��
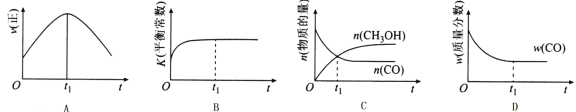
��2�����ھ��ȡ����ݵ��ܱ������г���1 mol CO��2 mol H2������CO��g��+2H2��g��![]() CH3OH��g����Ӧ������ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ��Ϊƽ��״̬����______����ѡ����ĸ����
CH3OH��g����Ӧ������ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ��Ϊƽ��״̬����______����ѡ����ĸ����
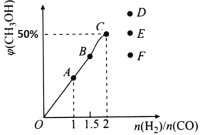
��3����T1��ʱ�������Ϊ5 L�ĺ��������г���3 mol�ĺϳ�������Ӧ�ﵽƽ��ʱCH3OH�����������n��H2����n��CO���Ĺ�ϵ��ͼ��ʾ��H2��CO��2:1Ͷ��ʱ����5 min�ﵽƽ�⣬��5 min����H2��ʾ�ķ�Ӧ����Ϊv��H2��=_______���¶Ȳ��䣬��![]() ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�______�㡣
ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�______�㡣
��4�����м״��ķ�ˮ�����ŷŻ����ˮ��Ⱦ������ClO2��������ΪCO2��Ȼ���ټӼ��кͼ��ɡ�д�������״����Է�ˮ�����У�ClO2��״���Ӧ�����ӷ���ʽ��________________________��
��5��ˮ����ż����ɱ�ʾΪH2O+H2O![]() H3O++OH-����ˮ�������ƣ��״�Ҳ�ܷ�����ż���룬��д���״�����ż���뷽��ʽ_______________________________________�����״��м������������Ʒ�Ӧ���ɼ״��ƣ���Ӧ��Ļ��Һ�еĵ���غ�ʽ_____________________________��
H3O++OH-����ˮ�������ƣ��״�Ҳ�ܷ�����ż���룬��д���״�����ż���뷽��ʽ_______________________________________�����״��м������������Ʒ�Ӧ���ɼ״��ƣ���Ӧ��Ļ��Һ�еĵ���غ�ʽ_____________________________��
���𰸡���1��CO��g��+2H2��g��![]() CH3OH��l�� ��H= -574.4kJ/mol ��3���� ��2��D��2����
CH3OH��l�� ��H= -574.4kJ/mol ��3���� ��2��D��2����
��3��0.06 molL-1min-1 ��2������F��2����
��4��6ClO2 +5CH3OH��5CO2 +6Cl -+6H++7H2O��2����
��5��CH3OH+CH3OH![]() CH3OH2++CH3O -��2���� c��CH3OH2+��+ c��Na+����c��CH3O -����2����
CH3OH2++CH3O -��2���� c��CH3OH2+��+ c��Na+����c��CH3O -����2����
��������
�����������1����֪��CO��H2��CH3OH����ȼ��������H���ֱ�Ϊ-283.0kJ/mol��-241.8kJ/mol��-192.2 kJ/mol������CO��g��+1/2O2��g��=CO2��g����H=-283.0kJmol-1
��2H2��g�� + O2��g�� = 2H2O��l�� ��H=��483.6kJ/mol
��CH3OH��l��+3/2O2��g��=CO2��g��+2 H2O��l����H=-192.2kJmol-1
�ɸ�˹���ɿ�֪��+��-���÷�ӦCO��g�� + 2H2��g����CH3OH��l����H����-283-483.6+192.2��kJmol-1����574.4kJ/mol��
��2��A������ƽ���������������ȣ����ٱ仯����t1ʱ��V�����֮�����ʼ�С��A����B���÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ������ߣ�ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ�B����C��t1ʱ�̺�һ����̼���״������ʵ��������仯��t1ʱ��δ����ƽ��״̬��C����D��t1ʱ�̣�CO����������Ϊ��ֵ������ƽ��״̬��ͼ����ʵ�ʷ��ϣ�D��ȷ����ѡD��
��3������ͼ���֪H2��CO��2:1Ͷ��ƽ��ʱ�״��ĺ�����0.5������ݷ���ʽ��֪
CO��g��+2H2��g��![]() CH3OH��g��
CH3OH��g��
��ʼ����mol�� 1 2 0
ƽ������mol�� n 2n n
ת������mol��1��n 2��2n n
�����![]()
���n��0.75
����5 min����H2��ʾ�ķ�Ӧ����Ϊ![]() ��0.06 molL-1min-1��
��0.06 molL-1min-1��
�¶Ȳ��䣬��![]() ʱ���������ʵ������ӣ�CO��ת��������������ת���ʼ�С����˲����ļ״������ʵ�����С�������ﵽƽ��״̬ʱCH3OH������������������������ͼ���е�F����
ʱ���������ʵ������ӣ�CO��ת��������������ת���ʼ�С����˲����ļ״������ʵ�����С�������ﵽƽ��״̬ʱCH3OH������������������������ͼ���е�F����
��4����Ӧ��ClԪ�ػ��ϼ۴ӣ�4�����͵���1�����õ�5�����ӡ�̼Ԫ�ػ��ϼ�����2�����ߵ���4����ʧȥ6����������˸��ݵ��ӵ�ʧ�غ��֪ClO2��״���Ӧ�����ӷ���ʽΪ6ClO2 +5CH3OH��5CO2 +6Cl -+6H++7H2O��
��5������ˮ����ż����ɱ�ʾΪH2O+H2O![]() H3O++OH-��֪�״�����ż���뷽��ʽΪCH3OH��CH3OH
H3O++OH-��֪�״�����ż���뷽��ʽΪCH3OH��CH3OH![]() CH3OH2+��CH3O -�����״��м������������Ʒ�Ӧ���ɼ״��ƣ���Ӧ��Ļ��Һ�еĵ���غ�ʽΪc��CH3OH2+��+ c��Na+����c��CH3O -����
CH3OH2+��CH3O -�����״��м������������Ʒ�Ӧ���ɼ״��ƣ���Ӧ��Ļ��Һ�еĵ���غ�ʽΪc��CH3OH2+��+ c��Na+����c��CH3O -����


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G���ֶ�����Ԫ�أ���ԭ��������������A��ԭ����û�гɶԵ��ӣ�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ���������������ڲ��������3����D��G����ͬһ�壻F�ǵؿ��к�����ߵĽ���Ԫ�ء���ش��������⣺
��1��Ԫ��F�����ڱ��е�λ�� ��
��2��B��C��D����Ԫ�صĵ�һ�������ɴ�С��˳���� ����Ԫ�ط��ű�ʾ����
��3�������Ni(BD)4������ΪҺ̬��������CCl4�������л��ܼ�����˹�̬Ni(BD)4���� ��������ͣ���
��4��CA3���ӵĵ���ʽΪ ��
��5��ED�����������²��ϣ��侧��ṹ��NaCl�������ơ�ED���۵��NaCl�ߣ���ԭ���� ��
��6����A��D��G��������Ԫ�ع��ɼס������־���18�����ӵķ��ӣ�����ԭ�ӵ���Ŀ����Ϊ3��4������ӵ�����ԭ�Ӳ�ȡ �ӻ���1 mol�ҷ��Ӻ��� mol�Ҽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����CoCl2��6H2O��NH4Cl��H2O2��Һ�����Ȼ��Ϊԭ�ϣ��ڻ���̿���ºϳ��˳Ȼ�ɫ����X��Ϊ�ⶨ����ɣ���������ʵ�顣
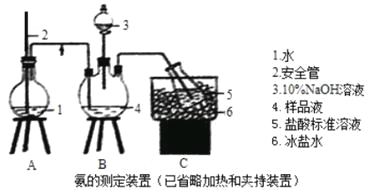
�����IJⶨ����ȷ��ȡwgX��������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ�������10%NaOH��Һ��ͨ��ˮ����������Ʒ��Һ�еİ�ȫ����������V1mLc1mol��L��1��������Һ���ա�����������ȡ�½���ƿ����c2mol��L��1NaOH����Һ�ζ���ʣ��HCl�����յ�ʱ����V2mLNaOH��Һ��
���ȵIJⶨ��ȷ��ȡ��ƷX�������Һ����AgNO3����Һ�ζ���K2CrO4��ҺΪָʾ����������ש��ɫ����������ʧΪ�յ㣨Ag2CrO4Ϊש��ɫ����
�ش��������⣺
��1��װ���а�ȫ�ܵ�����ԭ���� ��
��2����NaOH����Һ�ζ���ʣ��HClʱ��Ӧʹ�� ʽ�ζ��ܣ���ʹ�õ�ָʾ��Ϊ ��
��3����Ʒ�а���������������ʽΪ ��
��4���ⶨ��ǰӦ�ö�װ�ý��������Լ��飬�������Բ��òⶨ����� ������ƫ��������ƫ��������
��5���ⶨ�ȵĹ����У�ʹ����ɫ�ζ��ܵ�ԭ���� ���ζ��յ�ʱ������Һ��c(Ag��)=2.0��10��5mol��L��1��c(CrO42��)Ϊ mol��L��1������֪��Ksp(Ag2CrO4)=1.12��10��12��
��6�����ⶨ����ƷX���ܡ������ȵ����ʵ���֮��Ϊ1:6:3���ܵĻ��ϼ�Ϊ ���Ʊ�X�Ļ�ѧ����ʽΪ ��X���Ʊ��������¶Ȳ��ܹ��ߵ�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����ijһ�ֻ�ѧԪ�ء�
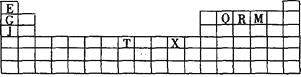

��1��д����̬T3+�ĺ�������Ų�ʽ�� ��T�����ڱ������ڷ���Ϊ ��
��2��Q��R��M�ĵ�һ�������ɴ�С��˳���� (��Ԫ�ط��ű�ʾ)��ԭ�� ��
��3�������й�����Ԫ�ص�˵����ȷ���� ��
A��J��X���ã�����J��������Һ���û���X |
B����J2M2����ˮ��Ҫ�ƻ����Ӽ����ۼ� |
C��RE3�е����QE4����Ҫ����Ϊǰ����Է��������ϴ� |
D��һ��Q2E4�����к������������һ������ |
��4��G2O���۵��J2O�� �������������������� ����ԭ���� ��
��5�� G��R����ֱ�ӻ�������һ�����ӻ�����G3R���þ����������ʯī�IJ�״�ṹ��ÿ���У�Gԭ�ӹ���ƽ�������Σ�ÿ�������ε�������һ��Rԭ�ӡ������֮�仹����һ��������ԭ�ӡ�������Щ���ӵ�ԭ��Ӧ���� (��G��R��Ԫ�ط���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Ľṹ����������ʽ����ʾ����CH3-CH=CH-CH3�ɼ�дΪ![]() ���л���X�ļ���ʽΪ
���л���X�ļ���ʽΪ![]() ��Y��X��ͬ���칹�壬�����ڷ������������й�Y��˵����ȷ����( )
��Y��X��ͬ���칹�壬�����ڷ������������й�Y��˵����ȷ����( )
A��Y��ʹ����KMnO4��Һ��ɫ�������DZ���ͬϵ��
B��Y��ʹ��ˮ��ɫ���Ҿ��úֲ�
C��Y���ܷ���ȡ����Ӧ
D��Y�ܷ����Ӿ۷�Ӧ����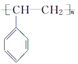
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������AgBr��������ˮ�У���Һ�д���AgBr(s)![]() Ag��(aq)��Br��(aq)��������˵����ȷ���ǣ� ��
Ag��(aq)��Br��(aq)��������˵����ȷ���ǣ� ��
A�������ϵ�еμ�����ŨNaCl��Һ�����ֳ���ת��Ϊ��ɫ��˵��Ksp(AgCl)��Ksp(AgBr)
B��ij��Һ��c(Ag��)��c(Br��)=Ksp(AgBr)��˵����ʱc(Ag��)=c(Br��)
C�������ϵ�м�������AgBr���壬ƽ�������ƶ������ٴ�ƽ��ʱc(Ag��)��c(Br��)����
D������ϵ��һ������c(Ag��)=c(Br��)=[Ksp(AgBr)]1/2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
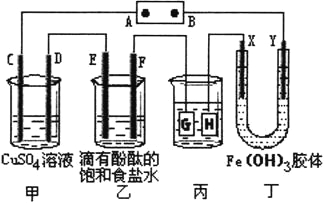
����Ŀ������ͼ��ʾ��C��D��E��F��X��Y���Ƕ��Ե缫���ס�������Һ�������Ũ�ȶ���ͬ������ͨ��ǰ����Һ������䣩��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ����X����������ɫ��dz��Y����������ɫ�����ش�
��1�����ס���װ���е�C��D��E��F�缫��ֻ��һ�ֵ�������ʱ����Ӧ���ʵ����ʵ���֮��Ϊ__________��
��2�����ñ�װ�ø�ͭ����������������Һ��pH��13ʱ����ʱ����Һ���Ϊ500mL�������жƼ���������������Ϊ__________��
��3��Fe(OH)3������Ʊ����ϸ��Ҫ��С������FeCl3��Һ�еμ�NaOH��Һ���Ʊ�Fe(OH)3���壬����ܿ�������˺��ɫ�ij������������Һ��pH=5�����ʱ��Һ��c(Fe3��)=__________mol/L������֪Ksp[Fe(OH)3]=1��10��36����
��4�����ü���ȼ�ϵ�أ��������ҺΪ2L2mol/LKOH��Һ���ṩ��Դ������ͨ����飬�ڱ�״���£����ļ�������VL��������CH4�������44.8��V��89.6ʱ����ʱ��Դ��B�������ĵ缫��ӦΪ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ����Ϊ��̬���̬���������ж���ȷ���ǣ� ��
(��) I2(?)��H2(g) ![]() 2HI(g) ��H��-9.48 kJ/mol
2HI(g) ��H��-9.48 kJ/mol
(��) I2(?)��H2(g) ![]() 2HI(g) ��H��26.48 kJ/mol
2HI(g) ��H��26.48 kJ/mol
A�����е�Ϊ��̬�����е�Ϊ��̬
B����Ӧ(��)�IJ���ȷ�Ӧ(��)�IJ����ȶ�
C��1 mol I2(g)��ͨ��1 mol H2(g)����Ӧ����9.48 kJ
D��1 mol��̬����1 mol��̬���������������17.00 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������������װһ������ʯ�͵�װ�ã�����������õ����ͺ�ú�͡�
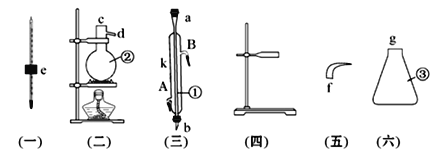
��1��д���������������ƣ�
��__________________����___________________����_________________��
��2��������������������˳������ĸa��b��c�����������ӣ�
e��__________��_________��_________��_________��_________
��3����������A����__________��B����__________��
��4������ʱ���¶ȼ�ˮ����Ӧ��______________________��λ�ã���
��5���ڢ���ע��ԭ�ͺӼ�Ƭ���Ƭ��Ŀ����_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com