
【题目】(16分)汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)2CO2(g)+N2(g)△H=﹣746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)2CO(g)△H=﹣221.0KJ/mol
C (s)+O2(g)CO2(g)△H=﹣393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJmol﹣1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 | |||||||
C(NO)10﹣4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | |||||||
C(CO)10﹣3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | |||||||
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
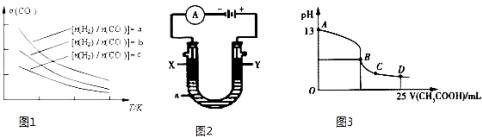
①a、b、c按从大到小的顺序排序为 。
②根据图象可以判断该反应为放热反应,理由是 。
(5)CO分析的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2﹣。
①则负极的电极反应式为 。
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为 g。
【答案】(1)+180.5 kJmol﹣1; (2)D; (3)0.6; =;(4)① a>b>c;
②投料比相同,温度越高CO的转化率越低,平衡向左移动,推得该反应为放热反应;
(5)① CO+2O2﹣﹣2e﹣=CO32﹣; ②2.8g
【解析】
试题分析:(1)已知热化学方程式①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.5KJ/mol
2CO2(g)+N2(g)△H=-746.5KJ/mol
②2C(s)+O2(g)![]() 2CO(g)△H=-221.0KJ/mol
2CO(g)△H=-221.0KJ/mol
③C(s)+O2(g)![]() CO2(g)△H=-393.5KJ/mol
CO2(g)△H=-393.5KJ/mol
根据盖斯定律可知③×2-①-②即得到反应N2(g)+O2(g)=2NO(g)的反应热△H=(746.5+221.0-393.5×2)kJ·mol-1=+180.5kJ·mol-1。
(2)由题中所给数据可知第1s~3s c(NO)减小3×10-4 mol/L,则1s~2s的变化量必介于1.5×10-4 mol/L~3×10-4 mol/L之间,答案选D。
(3)①根据实验i组的数据,CO的起始量为4mol,平衡量为2.4mol,反应消耗掉1.6mol,根据化学方程式可知,CO2的生成量为1.6mol,所以v(CO2)表示的反应速率为1.6mol÷(2L×5min)=0.16mol·L-1·min-1 ;
②根据第②组数据可得关系式为
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol)1 2 0 0
平衡量(mol)0.6 1.6 0.4 0.4
在900℃时的K=(0.2×0.2)÷(0.8×0.3)=1/6
如果温度仍然是900℃,则
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 2 1 0 0
平衡量(mol)2-x 1-x x x
即x2÷[(2-x)(1-x)]=1/6
解得x=0.4,则c=0.6mol。
α2(H2O)=40%,α3(CO)=40%,所以α2(H2O)=α3(CO)。
(4)①在其他条件不变时,增大氢气的浓度可以提高CO转化率,则根据图像可知a、b、c按从大到小的顺序排序为a>b>c。
②根据图像可知在比值不变时,升高温度CO转化率降低,这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应。
(5)①在原电池中,负极失去电子发生氧化反应,而CO在负极通入,所以负极的电极反应式为CO+2O2﹣﹣2e﹣=CO32﹣。
②惰性电极电解氯化钾溶液的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。根据图像可知氢氧化钾溶液的浓度是0.1mol/L,则反应中生成氢氧化钾是0.2mol,转移0.2mol电子,所以根据电子得失守恒可知消耗CO是0.1mol,则CO的质量是2.8g。
Cl2↑+H2↑+2OH-。根据图像可知氢氧化钾溶液的浓度是0.1mol/L,则反应中生成氢氧化钾是0.2mol,转移0.2mol电子,所以根据电子得失守恒可知消耗CO是0.1mol,则CO的质量是2.8g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是 ( )

A.图1表示向100mL 1 mol·L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系
B.图2表示向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液,沉淀物质的量变化的关系
C.图3表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________。

(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数目为_________。
(3)用NH3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。她成为首获科学类诺贝尔奖的中国人。青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯。下列有关说法正确的是

A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mol/L,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1mol/LNa2CO3中c(HCO3﹣)比0.1mol/LH2CO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的外围电子排布式为 ;

(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)Co的一种氧化物的晶胞如下图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。


查看答案和解析>>
科目:高中化学 来源: 题型:
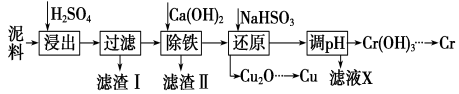
【题目】工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
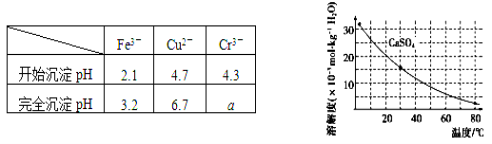
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__________________。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约________,检验Fe3+已经除尽的操作是_________________;
②将浊液加热到80℃,______________________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是_______。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥______。[已知:Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
根据①~⑿元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)

(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)画出原子结构示意图:⑾ 。
(5)用电子式表示⑦和⑩形成化合物的过程: 。
(6)⑦和⑧分别形成的气态氢化物的化学式是 、 。其中相对不稳定的是 。
(7)在③与④中,化学性质较活泼的是 ,(填元素符号)
在⑧与⑿中,化学性质较活泼的是 ,(填元素符号)如何证明(用离子方程式表示):
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】盐酸普鲁卡因(![]() )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
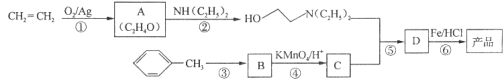
已知:①![]()
②![]()
③
请回答以下问题:
(1)A的核磁共振氢谱只有一个峰,则A的结构简式为____________________。
(2)C的结构简式为__________,C中含有的含氧官能团的名称为__________。
(3)合成路线中属于氧化反应的有_________(填序号),反应③的反应类型为_______________。
(4)反应⑤的化学反应方程式为______________________________________________。
(5)B的某种同系物E,相对分子质量比B大28,其中—NO2与苯环直接相连,则E的结构简式为____________________(任写一种)。
(6)符合下列条件的E的同分异构体的数目有__________种。
①结构中含有一个“—NH2”与一个“—COOH” ②苯环上有三个各不相同的取代基
(7)苯丙氨酸(![]() )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com