
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3,还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下:

(1)滤渣A是 ,滤渣B是 。
(2)过程I、II、III的分离操作的名称是 。
(3)过程IV中灼烧时盛放药品的仪器名称是 ,发生反应的化学方程式是 。
(4)过程III中发生反应生成滤渣C的离子方程式表示为 。
(5)取滤液B100mL,加入1molL-1盐酸200mL时,沉淀量达到最大且质量为11.7g。则溶液B中c(Al[(OH)4]-)= ,c(Na+)> mol·L-1。
【答案】(1)SiO2(或二氧化硅) Fe(OH)3(或氢氧化铁) (2)过滤
(3)坩埚 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
(4)【Al(OH)4】—+CO2=Al(OH)3↓+HCO3— (5)1.5mol·L-1 6.0
【解析】
试题分析:(1)铝土矿中的二氧化硅与稀硫酸不反应,则滤渣A是SiO2(或二氧化硅);滤液A中含有铝离子、铁离子,加入过量的氢氧化钠溶液生成偏铝酸钠和氢氧化铁测定,则滤渣B是Fe(OH)3(或氢氧化铁)。
(2)过程I、II、III的分离操作的名称均是过滤。
(3)过程IV中灼烧固体时盛放药品的仪器名称是坩埚。滤液B中含有偏铝酸钠,通入过量的二氧化碳生成氢氧化铝测定,则发生反应的化学方程式是2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。
(4)由于二氧化碳是过量的,则过程III中发生反应生成滤渣C的离子方程式表示为【Al(OH)4】—+CO2=Al(OH)3↓+HCO3—。
(5)取滤液B100mL,加入1molL-1盐酸200mL时,沉淀量达到最大且质量为11.7g,即氢氧化铝是11.7g,物质的量是11.7g÷78g/mol=0.15mol,所以根据铝原子守恒可知溶液B中c(Al[(OH)4]-)=0.15mol÷0.1L=1.5mol/L。根据方程式Al2(SO4)3+8NaOH=3Na2SO4+2NaAlO2+4H2O可知消耗氢氧化钠是0.6mol,则溶液中钠离子浓度是6mol/L。又因为氢氧化钠还要与硫酸铁反应,因此最终滤液B中钠离子大于6.0mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:

已知以下信息:
①![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的外围电子排布式为 ;

(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)Co的一种氧化物的晶胞如下图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):

(1)若D为白色胶状难溶物,且与A摩尔质量相等,反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸(无氧酸),则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
根据①~⑿元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)

(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)画出原子结构示意图:⑾ 。
(5)用电子式表示⑦和⑩形成化合物的过程: 。
(6)⑦和⑧分别形成的气态氢化物的化学式是 、 。其中相对不稳定的是 。
(7)在③与④中,化学性质较活泼的是 ,(填元素符号)
在⑧与⑿中,化学性质较活泼的是 ,(填元素符号)如何证明(用离子方程式表示):
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。



图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]()
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。某化学兴趣小组同学展开对亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用下图所示装置进行实验。

(1)装置②中产生ClO2气体的化学方程式为 。
(2)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。过滤用到的玻璃仪器有 。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作是: 。
(4)反应结束后,关闭K2、打开K1,装置①的作用是 ;如果撤去D中的冷水浴,可能导致产品中混有的杂质是 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]布洛芬缓释高分子药物P的合成路线如下:

已知:
(1)A为一元羧酸,8.8g A与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式是
。
(2)B和E的核磁共振氢谱都只有2种峰,D的系统名称是 ,E含有的官能团是 。
(3)D与过量的E反应生成F;若D过量,将得到F′。F′的结构简式是 。
(4)反应条件Ⅰ是 ,G生成P的反应类型 。
(5)P用NaOH水溶液处理的化学方程式是 。
(6)写出2种符合下列要求的布洛芬的同分导构体:①含有苯环和酯基;②其核磁共振氢谱为4组峰,且峰面积比为9:6:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
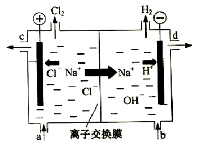
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为: 、
。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com