
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。



图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]()
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
【答案】(1)119.88
(2)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(3)2NO3-+12H++10e-=N2↑+6H2O; 180
(4)1024
(5)BD
(6)①250℃~300℃时,催化剂的催化效率降低②250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动
【解析】
试题分析:
(1)根据盖斯定律可知②×2—①即可得到CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=—599.4kJ/mol。4.48LCH4的物质的量是0.2mol,所以还原NO生成N2放出的热量为599.4kJ/mol×0.2mol=119.88kJ。
(2)在酸性溶液中硝酸根氧化亚铁离子的方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
(3)电解时阴极得到电子,发生还原反应,则根据示意图可知硝酸根得到电子转化为氮气。由于存在质子交换膜,阳极氢氧根放电,水电离出的氢离子向阴极移动,所以阴极电极反应式为2NO3-+12H++10e-=N2↑+6H2O;当电路中转移20 mol电子时,根据电子得失守恒和2H2O+4e-=O2↑+4H+可知被电解的水是10mol,质量是180g,则交换膜左侧溶液质量减少180g。
(4)根据图像可知T1时,CO2的体积分数是0.8,则CO2是0.8×5mol=4mol,CO是1mol,所以根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知该反应的化学平衡常数的数值为![]() 。
。
(5)A.密度是混合气的质量和容器容积的比值,在反应过程中体积不被,但气体的质量变化,所以容器内气体密度不变,表明反应达到平衡状态,A正确;B.两种温度下,c点时体系中温度不同,所以混合气体的压强不相等,B错误;C.d点时,在原容器中充入一定量氦气,浓度不变,平衡不移动,所以CO的转化率不变,C正确;D.T2曲线首先平衡,说明温度是T2大于 T1。温度高CO2的含量降低,说明升高温度平衡向逆反应方向进行,则平衡常数减小,所以b点和d点时化学平衡常数的大小关系:Kb>Kd,D错误,答案选BD。
(6)①根据图像可知250—300℃时,乙酸的生成速率减小的主要原因是250℃~300℃时,催化剂的催化效率降低。②由于250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动,所以工业生产中该反应的温度常选择250℃、不选择400℃。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
![]()

可能用到的有关数据如下:

实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1) 仪器b的名称为__________。
(2) 向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:____________________。
(3) 已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O 、NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:____________ _________、___________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.图是研究甲烷与氯气反应的实验装置图
(1)若研究甲烷与氯气的反应,还需要的条件是 。
(2)二氯甲烷有 种同分异构体。
(3)请完成一氯甲烷与氯气发生反应的化学方程式:CH3Cl+Cl2![]() +HCl,该反应属于反应 (填有机反应类型)。
+HCl,该反应属于反应 (填有机反应类型)。
Ⅱ.(4)1mol某烷烃完全燃烧消耗8molO2,则其化学式为 ,写出该烷烃同分异构体中支链最多的烷烃的系统命名为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
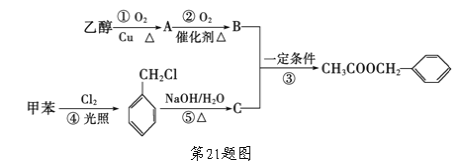
(1)C的结构简式为_______________,B中含氧官能团的名称是____________。
(2)实验室A的方法是:__________________________________________
______________________________________________________________。
(3)写出反应①、⑤的化学方程式:
① ________________________________________;
⑤ ________________________________________。
(4)反应③、④的反应类型分别为③____________、④____________。
(5)反应____(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3,还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下:

(1)滤渣A是 ,滤渣B是 。
(2)过程I、II、III的分离操作的名称是 。
(3)过程IV中灼烧时盛放药品的仪器名称是 ,发生反应的化学方程式是 。
(4)过程III中发生反应生成滤渣C的离子方程式表示为 。
(5)取滤液B100mL,加入1molL-1盐酸200mL时,沉淀量达到最大且质量为11.7g。则溶液B中c(Al[(OH)4]-)= ,c(Na+)> mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是生物体的一种代谢产物,菠菜、苋菜等植物中富含草酸,但在人体中容易与钙离子形成草酸钙导致肾结石。某化学研究小组为了研究草酸,查阅资料获取了以下信息。
① 草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易升华,易溶于水。
② 草酸晶体受热脱水,170℃以上分解产生CO、CO2和H2O。
③ 草酸为二元酸:K1=5.4×10-2,K2=5.4×10-5。
④ 草酸的钠盐和钾盐易溶于水。
(1)研究小组为了验证草酸受热分解产生的CO2,按照如下图所示的装置进行实验。装置B中可观察到的现象是 。但研究小组指导老师认为实验方案欠妥,要求改进实验。小组同学一致同意在A、B之间再加入一个实验装置C,其作用是 ,请在下图方框中画出该装置,并标明所需试剂。

(2)研究小组为了验证草酸受热分解产生的CO,按照(1)实验中的装置A、C和下图所示的部分装置(可以重复选用)进行实验。

实验装置依次连接的合理顺序为A→C→ →H→D→I。装置H反应管中盛有的物质是 。
(3)经过实验(1)和(2)证明草酸晶体受热分解产生了CO和CO2。请写出草酸晶体受热分解的化学方程式 。
(4)为了测定某草酸溶液的物质的量浓度,该小组查阅文献发现硫酸酸化的高锰酸钾溶液可以氧化草酸并放出CO2,反应的离子方程式为 。若利用已知浓度的酸性高锰酸钾标准液滴定未知浓度的草酸溶液,滴定终点判断方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6![]() LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A. 充电时,电池的负极反应为LiC6-e-Li++C6
B. 放电时,电池的正极反应为CoO2+Li++e-LiCoO2
C. 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D. 锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录如下表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
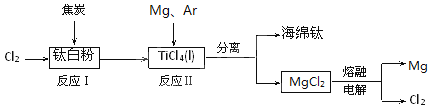
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)反应Ⅰ在800~900℃下进行,还生成一种可燃性无色气体,
该反应的化学方程式为 。
(2)反应Ⅱ的热化学方程式为 。
(3)反应Ⅱ中充入气体Ar的原因是 。
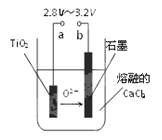
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右上图所示。
图中b是电源的 极,阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com