
【题目】Ⅰ.图是研究甲烷与氯气反应的实验装置图
(1)若研究甲烷与氯气的反应,还需要的条件是 。
(2)二氯甲烷有 种同分异构体。
(3)请完成一氯甲烷与氯气发生反应的化学方程式:CH3Cl+Cl2![]() +HCl,该反应属于反应 (填有机反应类型)。
+HCl,该反应属于反应 (填有机反应类型)。
Ⅱ.(4)1mol某烷烃完全燃烧消耗8molO2,则其化学式为 ,写出该烷烃同分异构体中支链最多的烷烃的系统命名为 。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72–转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。

①和②溶液中的Cr2O72–浓度随时间变化关系如图所示。
(2)上述反应中参加反应的Cr2O72–与草酸的物质的量之比为_____________。
(3)实验①和②的结果表明______________________________________;实验①中0~t1时间段反应速率v(Cr3+)=__________________________________(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:____________________________;
假设三:____________________________;
(5)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72–的浓度可用仪器测定。]
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,已列出10种元素在周期表中的位置。按要求回答下列问题。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
第2周期 | ⑦ | ⑧ | ||||||
第3周期 | ① | ③ | ⑤ | ④ | ⑨ | ⑩ | ||
第4周期 | ② | ⑥ |
(1)10种元素中,形成气态氢化物最稳定的是 元素(填素符号)。
(2)⑥的最高价的氧化物与氢氧化钠反应的化学方程式为____________________。
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)________>________>________>________。
(4)④、⑦元素形成的氢化物中,沸点较高的是_____,理由是_______。
(5)用一个实验事实(或一个化学方程式)证明④、⑨元素的非金属性更强的是⑨:______。
(6)用电子式表示③⑧形成化合物的过程 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种重要的的制药原料,以有机物A(OHC-COOH)、B和其它原料在一定条件下可以合成有机物F,合成路线如下:

(1)有机物B的名称 ,D的分子式为 。
(2)A与B反应生成C的反应类型为 。
(3)有机物C与足量的碳酸氢钠溶液反应的化学方程式 。
(4)E是由2分子C生成的含有3个六元环的化合物,其结构简式为 。
(5)符合下列条件的D的所有同分异构体(不考虑立体异构)的结构有 种。
①苯环上只有2个处于对位的取代基;②遇氯化铁溶液显紫色;③分子中含有一个羧基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的外围电子排布式为 ;

(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)Co的一种氧化物的晶胞如下图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:

(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为 (写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):

(1)若D为白色胶状难溶物,且与A摩尔质量相等,反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸(无氧酸),则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。



图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]()
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
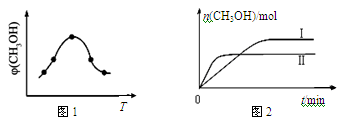
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。判断的理由 。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。开始以氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Kb=4.3×10-7,则NH4HCO3溶液呈 (填“酸性”、“中性”、“碱性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com