
【题目】有机物F是一种重要的的制药原料,以有机物A(OHC-COOH)、B和其它原料在一定条件下可以合成有机物F,合成路线如下:

(1)有机物B的名称 ,D的分子式为 。
(2)A与B反应生成C的反应类型为 。
(3)有机物C与足量的碳酸氢钠溶液反应的化学方程式 。
(4)E是由2分子C生成的含有3个六元环的化合物,其结构简式为 。
(5)符合下列条件的D的所有同分异构体(不考虑立体异构)的结构有 种。
①苯环上只有2个处于对位的取代基;②遇氯化铁溶液显紫色;③分子中含有一个羧基。
【答案】(1)苯酚 C9H10O4
(2)加成反应
(3)![]()
(4) 
(5)10种
【解析】
试题分析:C与甲醇反应生成D,由D的结构可知应是发生酯化反应,可推知C为![]() ,B与OHC-COOH反应生成C,应是发生加成反应,可知B为苯酚.副产物E是由2分子C生成的含有3个六元环的化合物,其结构简式为
,B与OHC-COOH反应生成C,应是发生加成反应,可知B为苯酚.副产物E是由2分子C生成的含有3个六元环的化合物,其结构简式为 ,对比D、F的结构可知,D中-OH被-Br取代生成F;
,对比D、F的结构可知,D中-OH被-Br取代生成F;
(1)有机物B为苯酚,由D的结构简式可知,D的分子式为C9H10O4;
(2)A与B反应生成C的反应类型为加成反应;
(3)有机物C与足量的碳酸氢钠溶液反应的化学方程式:
![]() ;
;
(4)E是由2分子C生成的含有3个六元环的化合物,其结构简式为 ;
;
(5)符合下列条件的D的所有同分异构体:
①苯环上只有2个处于对位的取代基;②遇氯化铁溶液显紫色,说明含有酚羟基,③分子中含有一个羧基,则另乙侧链为:-CH(OH)CH2COOH、-CH2CH(OH)COOH、-C(OH)(CH3)COOH、-CH(CH2OH)COOH、-OCH2CH2COOH、-CH2OCH2COOH、-CH2CH2OCOOH、-OCH(CH3)COOH、-CH(CH3)OCOOH、-CH(OCH3)COOH,符合条件的共有10种。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)写出XZ和X2Y的化学式:XZ X2Y
(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是 (写化学式)。
(3)写出实验室制取X的单质的离子方程式 _______________。
(4)Z的单质能否与氢氧化钠溶液发生反应: (填“能”或“否”),若能,请写出反应的离子方程式: _______________。
(若不能反应,则此空不必填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
![]()

可能用到的有关数据如下:

实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1) 仪器b的名称为__________。
(2) 向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:____________________。
(3) 已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O 、NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:____________ _________、___________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。己知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是_______________。
(2)C2B2所含的化学键类型有______;请写出C2B2和A2B反应的离子方程式___________。
(3)元素B、C所形成的简单离子中半径较大的是(写电子式)___________。
(4)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_____,如果该电池每转移1mol电子,消耗标准状况下A单质的体积为_______升,通入A单质的X溶液的pH 值将(填“增大”“不变”或“减小”)______;图中盐桥的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,高铁酸盐在碱性环境中比酸性环境中相对稳定。工业上用湿法制备高铁酸钾的基本流程如下图所示:

下列有关说法不正确的是
A.控制反应温度30℃以下的原因是防止生成的K2FeO4发生分解
B.结晶过程中加入浓KOH溶液其作用是增大K+浓度,促进K2FeO4晶体析出
C.滤液2中阳离子可通过焰色反应检验确定
D.湿法制备高铁酸钾,也可以在Fe(OH)3料浆中直接通入足量氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,正极的电极反应式为O2+2H2O+4e-==4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.图是研究甲烷与氯气反应的实验装置图
(1)若研究甲烷与氯气的反应,还需要的条件是 。
(2)二氯甲烷有 种同分异构体。
(3)请完成一氯甲烷与氯气发生反应的化学方程式:CH3Cl+Cl2![]() +HCl,该反应属于反应 (填有机反应类型)。
+HCl,该反应属于反应 (填有机反应类型)。
Ⅱ.(4)1mol某烷烃完全燃烧消耗8molO2,则其化学式为 ,写出该烷烃同分异构体中支链最多的烷烃的系统命名为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
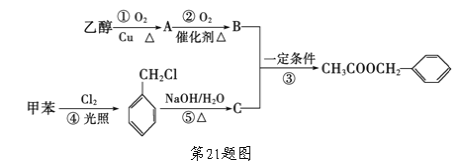
(1)C的结构简式为_______________,B中含氧官能团的名称是____________。
(2)实验室A的方法是:__________________________________________
______________________________________________________________。
(3)写出反应①、⑤的化学方程式:
① ________________________________________;
⑤ ________________________________________。
(4)反应③、④的反应类型分别为③____________、④____________。
(5)反应____(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录如下表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com